![]()
|
|
学科: 化学 |
| 教学内容:卤素达纲检测(B卷) |
【同步达纲练习】
一、选择题
1.下列试剂保存方法正确的是( )
A.金属钠放入四氯化碳中 B.液溴表面加水进行水封
C.溴化银放入无色玻璃瓶中 D.把潮湿的氯气贮存在钢瓶中
2.以下物质中,既可用金属与氯气经化合反应直接制取,又可用金属单质与盐酸经置换反应制取的是( )
A.氯化亚铁 B.氯化铜 C.氯化铁 D.氯化铝
3.向含有90gNaI溶液中加入40gBr2后,再向溶液中通入过量的Cl2,完全反应后,被还原的Cl2的物质的量为( )
A.0.6mol B.0.3mol C.0.1mol D.0.05mol
4.氯酸钾溶液与碘单质有如下反应:
2KClO3+I2=2KIO3+Cl2↑,从氧化还原的角度分析①碘单质是氧化剂 ②氯单质是氧化产物 ③氯酸钾是氧化剂 ④每生成0.1molCl2有lmol电子发生转移,结论正确的组合是( )
A.①④ B.③④ C.②④ D.①②
5.下列物质的用途,利用氧化还原反应的是( )
A.用氯气消毒自来水
B.用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3)
C.用食盐腌渍食物
D.用小苏打治疗胃酸过多
6.制取氯水方法最合理的是( )
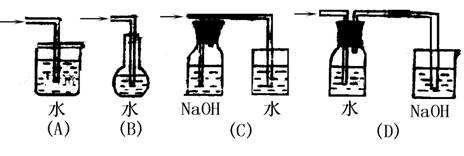
7.用30.1g卤化钾跟足量AgNO3溶液发生反应,生成42.6g沉淀,则该卤化钾的化学式是( )
A.KCl B.KF C.KBr D.KI
8.氯水中存在的微粒是( )
A.Cl2、H2O B.Cl2、H2O、Cl-
C.Cl2、HCl、HClO、H2O D.Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(极少)
9.漂白粉的氧化性远不如次氯酸,为何工业上用的漂白剂常用漂白粉而不用次氯酸,主要原因是( )
A.漂白粉比次氯酸经济 B.漂白粉较次氯酸稳定,易运输和保存
C.漂白粉漂白能力强于次氯酸 D.漂白粉较次氯酸易于制备
10.14.7gCaCl2的结晶水合物CaCl2·xH2O失去全部结晶水后,质量变为11.1g,通过计算可知x值为( )
A.1 B.2 C.3 D.4
11.等质量的锌和碘混合,加入少量水作催化剂,使之完全反应,生成碘化锌,此时未反应的锌占锌总质量的分数为( )
A.74.4% B.57.2% C.64.6% D.37.2%
12.如图A处通入Cl2,关闭B阀时,C处潮湿红色布条看不到明显现明,当打开阀后,C处逐渐褪色,则D瓶装的是( )
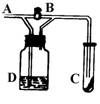
A.浓H2SO4 B.NaOH溶液
C.H2O D.饱和NaCl溶液
13.不同卤原子间可以共用电子对形成卤素互化物,其通式为XX′n(n=1,3,5,7).这种互化物绝大多数不稳定,易发生水解反应.已知BrFn和水反应时物质的量之比为3∶5,生成溴酸、氢氟酸、溴单质和氧气.试判断下列叙述正确的是( )
A.此卤素互化物的分子式为BrF3
B.此卤素互化物的分子式为BrF5
C.BrFn的性质类似卤素单质,有强还原性
D.每摩尔BrFn完全反应,可生成等物质的量的Br2和O2
14.把Cl2通入AgNO3溶液中,发现有白色沉淀生成,溶液中发生反应的离子方程式正确的是( )
A.Ag++Cl- = AgCl↓ B.Ag++Cl2 = AgCl↓+Cl-
C.Ag++Cl2+H2O = AgCl↓+2H++ClO- D.Ag++Cl2+H2O = AgCl↓+HClO+H+
15.VmL1mol·L-1AgNO3溶液恰好与同体积的下列溶液完全反应,这些溶液中物质的量浓度最大的是( )
A.KCl溶液 B.MgCl2溶液 C.BaCl2溶液 D.AlCl3溶液
16.含碘食盐中的碘是以碘酸钾(KIO3)形式存在的,已知在酸性溶液中IO3-可和I-发生下列反应:IO3-+5I-+6H+ = 3I2+3H2O,现有下列物质:①稀H2SO4;②pH试纸;③淀粉—KI溶液;④淀粉溶液,利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
A.④② B.①③ C.②③ D.①④
17.将KCl和CrCl3两种固体混合物共熔,得化合物X.X由K、Cr、Cl三种元素组成.将1.892gX中的铬元素全部氧化成Cr2O72-,后者可以从过量的KI溶液中氧化出2.667g碘单质(Cr2O72-+6I-+14H+ = 2Cr3++3I2+7H2O)如果取溶有1.892gX的溶液加入过量AgNO3溶液,可得到4.52gAgCl沉淀.则X的化学式为( )
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K3CrCl4
18.在粗碘中含ICl和IBr,受热时I2、ICl、IBr均可升华,在粗碘中加入一种物质后,再进行升华可制得精碘,应加入的物质是( )
A.H2O B.Zn C.KI D.KCl
19.实验室用二氧化锰和浓盐酸来制取氯气,主要操作有:①将蒸馏烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈放好石棉网;③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导气管放入集气瓶中;④检查装置的气密性;⑤在蒸馏烧瓶上装好分液漏斗,连结好导气管.正确的实验操作顺序是( )
A.②③④①⑤ B.②①③⑤④ C.②①⑤④③ D.②①③④⑤
20.将0.2molKMnO4在一定温度下加热后生成amolO2;将剩余固体与过量浓盐酸混合加又生成bmolCl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的值可能为( )
A.0.35 B.0.45 C.0.55 D.0.60
二、填空题
21.在O2、H2、Cl2、HF、HCl、HBr、HI、CO、CO2等气体中:(1)无色,无刺激性气味,但有毒的是 ;(2)有色,有刺激性气味的是 ;(3)可用排水法收集的是 ;(4)在其水溶液中滴入石蕊试液,先变红,后褪色的是 ;(5)常用作氧化剂的是 ,无色无味的还原剂是 ;(6)不可用排水法收集的是 ;(7)通入硝酸银溶液中,可生成不溶于稀硝酸的沉淀的是 ;(8)燃烧时发出蓝色火焰的是 .
22.Cl2在70°的NaOH溶液中,能同时发生两个自身氧化还原反应,反应的化学方程式为:
(1) ;
(2) ;
反应完全后测得溶液中NaClO和NaClO3的数目之比为4∶1,则溶液中NaCl和NaClO的物质的量之比为 .
三、实验题
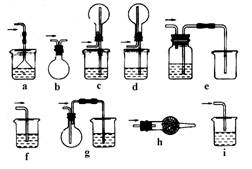
23.下图是课外活动小组同学设计的几种尾气吸收装置.从实验安全和保护环境的角度考虑,当用于吸收HCl气体时(装置中液体为水,固体为碱石灰),应选用的装置是 (选填装置序号);若用于吸收NH3,在上述已选用的装置中不宜采用的是 ,原因是 .
24.现用MnO2与浓盐酸反应制取氯气,再用Cu粉和Cl2制取少量CuCl2的实验,其实验流程示意图,如下:
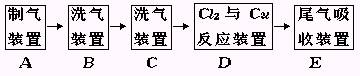
上图中“→”表示气体流向.请回答下列问题
(1)B与C所需仪器的名称是 ,B中应选用的试剂是 ,C中选用的试剂的作用是 .
(2)请设计一个Cl2和Cu粉反应的实验装置(用装置图表示并注明试剂名称),说明根据什么现象判断已有CuCl2生成.
(3)E中发生反应的化学方程式为 .
四、推断题
25.根据下图转化关系回答下列问题
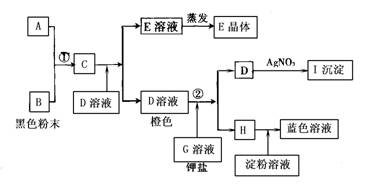
(1)写出①的离子反应方程式: ;写出②的离子反应方程式: .
(2)推出下列物质或溶液中溶质的化学式.
E ,I .
(3)在上述转化过程中,判断B、C、F、H氧化能力由弱到强的顺序(写化学式): .
五、计算题
26.将36mLKBr和KI的混合溶液分为二等份.向其中一份通入足量Cl2,完全反应后蒸发溶液至干,灼烧所得物质,得到6.1g固体残留物.测得另一份混合液中I-的浓度为0.86mol/L.计算:
(1)固体残留物中含有什么物质?
(2)原溶液中含有KBr的质量是多少?
(3)反应完全时消耗Cl2的体积(标准状况)是多少?
27.现将含Ag+为5.4×10-2g的可溶性银盐溶液与某+2价金属离子的可溶性盐混合,恰好完全反应.得卤化物沉淀,经过滤、洗涤,并在250W的灯泡下烘干,得固体1.95×10-2g.试分析:
(1)溶液中得到的沉淀是卤化银吗?
(2)推导该卤化物沉淀的化学式.

参考答案:
【同步达纲练习】
B卷
一、1.B 2.D 3.B 4.B 5.A 6.D 7.D 8.D 9.B 10.B 11.A 12.B 13.AD 14.D 15.A 16.B 17.C 18.C 19.C 20.B
二、21.(1)CO (2)Cl2 (3)O2、H2、CO (4)Cl2 (5)O2、Cl2;H2、CO (6)Cl2、HF、HCl、HB、HI、CO2 (7)Cl2、HCl、HBr、HI (8)H2、CO
22.(1)Cl2+2NaOH = NaCl+NaClO+H2O
(2)3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
9∶4
三、23.adeh;h;氨气是碱性气体,不能被碱石灰吸水
24.(1)洗气瓶,饱和食盐水,吸收水蒸汽 (2)燃烧管、酒精灯、导气管、气体吸水装置(图略)、桔黄色物质出现 (3)Cl2+2NaOH=NaCl+NaClO+H2O
四、25.(1)①MnO2+2Cl-+4H+ = Mn2++Cl2↑+2H2O
②Br2+2I- = 2Br-+I2
(2) E:KCl,I:AgBr
(3)I2<Br2<Cl2<MnO2
五、26.(1)KCl (2)15.8g (3)0.92L
27.(1)假设得到的沉淀是卤化银,则在250W的灯泡光照下烘干时,卤化银见光分解生成的单质银的质量应仍为5.4×10-2g,现为1.95×10-2,所以该沉淀不是卤化银.
(2)由于所得沉淀为卤化物,故所取可溶性银盐必为AgF,产生的沉淀可设为MF2.则:
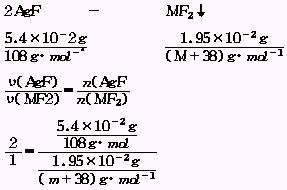
M=40,所以该卤化物沉淀为CaF2.
说明:解答本题,需要打破思维定势.AgF易溶,CaF2难溶.
