高一化学学期末能力测试模拟试卷(一)
一、选择题:(每题有一个正确答案)
1、下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是
A 苛性钠溶液 B 漂白粉 C 氯水 D 碘化钾
2、下列说法不正确的是
A、某溶液中滴入AgNO3溶液,产生白色沉淀,该溶液中不一定含Cl-。
B、某溶液与淀粉碘化钾溶液混合后显蓝色,证明该溶液是新制氯水。
C、将氟气通入氯化钠水溶液中,有氢氟酸和O2生成。
D、实验证明氯水也能导电,但氯水不是电解质。
3、下列叙述中正确的是:
A、阳离子一定是金属离子, 阴离子一定只含有非金属元素
B、 金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C、 阴、阳离子相互结合后一定形成离子化合物
D、金属K 不能从盐的水溶液中置换出金属单质
4、下列各组固体物质只需加水就可以区别开来的是:
A、NaOH、NH4NO3、NaCl B、CuSO4、Na2SO4、明矾
C、NaOH、KOH、Mg(OH)2 D、Na2CO3、NaHCO3、NaCl
5、某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是
A 30% B ![]() ×100% C 26.5% D
×100% C 26.5% D ![]() ×100%
×100%
6、当Na2O2与NaHCO3按质量比为39:84混合,在密闭容器加热后,最后排出气体物质,则所得残留物是
A.Na2O和Na2O2 B.Na2O2和Na2CO3 C.Na2CO3 D.Na2O
7、两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A 1对 B 2对 C 3对 D 4对
8、设NA 表示阿伏加德罗常数,下列说法不正确的是:
A.甲烷的摩尔质量与NA 个甲烷分子的质量在数值上相等.
B.NA 个氧气分子和NA 个氢气分子的质量比为16:1
C.28g氮气所含的原子数目为NA
D.NA 个H2SO4分子中所含氧原子个数与4NA 个H2O分子中所含氧原子个数相等.
9、根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A、K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B、L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C、L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D、M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
10、如果我们将12C的原子质量假设为n克,若某原子的质量为W克,则该原子的相对质量为:( )
A、(12W÷n)g/mol B、12n÷W C、6.02×1023W D、12×6.02×1023
11、下列反应的离子方程式正确的是
A、少量的二氧化硫气体通入到漂白粉水溶液中:SO2+2ClO-=SO32-+2HClO
B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D、铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
12、X、Y、Z 三种非金属元素具有相同的电子层数, 它们的气态氢化物的稳定性的强弱顺序为: XH3 < H2Y < HZ,下列说法中正确的是:
A、原子序数: X > Y > Z B、非金属性: X < Y < Z
C、原子半径: X < Y < Z D、离子的还原性: X3- < Y2- < Z-
13、实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选取一定规格的容量瓶进行配制,以下操作正确的是:
A.称取7.68 g硫酸铜,加入480 mL水 B.称取12.0 g胆矾配成480mL溶液
C.称取7.68g硫酸铜,加水到480mL D.称取12.5 g胆矾配成500 mL溶液
14、短周期元素 X 和 Y 可以形成 XY4 型化合物, 若 X 的原子序数为 m , Y 的原子序数为 n , 则 m 和n 的相互关系不可能为:
A. m – 13 = n B. n + 5 = m C. m + 8 = n D. n – 11 = m
15、A、B、C、D、E 是同一短周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性, 且碱性前者强于后者, C和D的气态氢化物的水溶液呈酸性, 且酸性前者强于后者, 五种元素形成的简单离子中,E的离子半径最小, 则它们的原子序数由大到小的顺序是:
A. CDEBA B. ECDAB C. BAEDC D. BADCE
16、某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体中一定含有的气体是:
A、HCl和CO B、HCl、H2和CO C、CH4和NH3 D、CO和CO2
17、将纯铁丝5.21克溶于过量的稀硫酸中,在加热下用2.53克KNO3去氧化溶液中的 Fe2+,待反应完全后,剩余的Fe2+尚需12.0毫升0.3摩/升的KMnO4溶液才能刚好完全氧化(已知KMnO4-的还原产物是Mn2+),请确定NO3-的还原产物:
A N2O B NO
C NO2
D NH3
18、某金属单质与一定量的稀硝酸反应,得到对应硝酸盐和NO和水,已知反应中消耗的金属单质与硝酸的物质的量之比为1:3,则该金属元素可能为:
A、Cu B、Ag C、Al D、Fe
19、在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为:
A 1︰1︰1 B 2︰2︰1 C 2︰3︰1 D 4︰3︰2
20、有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式为:( )
A、I2O4 B、I2O5 C、I4O7 D、I4O9
21、强热绿矾晶体发生如下反应:2FeSO4·7H2O==Fe2O3+SO3+SO2+14H2O。若将反应生成的气体物质全部通入到BaCl2溶液中去,则会:①有BaSO4白色沉淀生成②有BaSO3白色沉淀生成③有SO2气体逸出④有SO3气体逸出,其中正确的有:
A、①④ B、②④ C、①③ D、②③
22、已知Cu(NO3)2受热分解的化学反应方程式为:![]()
某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是:
A、NO2能支持燃烧 B、NO2不能支持燃烧
C、木条复燃是因为硝酸铜分解产生了氧气的缘故
D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果
二、填空题:
23、已知短周期的四种元素A、B、C、D形成的四种离子:A+、B2+、C-、D2-电子层结构相同,则四种元素的原子半径按小到大的顺序排列为_____________四种元素的原子序数按由大到小的顺序排列为___________________。
24、已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下气态单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 ,Y的电子式为:
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
三、实验题:
 25、某学生课外活动小组利用右图所示装置分别做如下实验:
25、某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是: ___________________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是_______溶液;加热时溶液由无色变为红色的原因是: ___________________________ 。
27、某课外兴趣小组利用右图所示的装置进行HNO3、NO2、NO联合性质实验,其过程如下:
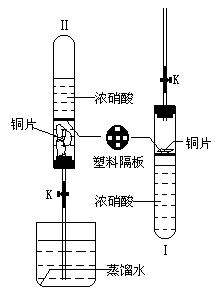 先在如图Ⅰ所示的装置中加入一定量的浓硝酸,在试管上部放上一片塑料隔板,在隔板上放上几片铜片(此时铜片与浓硝酸不接触),然后塞上带导气管的塞子,最后按图Ⅱ所示将它倒过来使铜和浓硝酸接触,并使导气管下端深入到蒸馏水中,然后打开夹子K。
先在如图Ⅰ所示的装置中加入一定量的浓硝酸,在试管上部放上一片塑料隔板,在隔板上放上几片铜片(此时铜片与浓硝酸不接触),然后塞上带导气管的塞子,最后按图Ⅱ所示将它倒过来使铜和浓硝酸接触,并使导气管下端深入到蒸馏水中,然后打开夹子K。
在实验过程中装置图Ⅱ中出现了如下的实验现象:
(1)铜片在塞子和塑料隔板之间翻滚并剧烈反应,产生了在量的红棕色气体集中在试管的上部空间,试管中的浓硝酸被逐渐压入下面烧杯中,到最后试管中只剩下几片未反应完的铜片和大量的红棕色的气体,且试管外壁非常烫。
(2)关闭K,让试管在空气中自然冷却,待冷却到室温时打开K,此时烧杯中的液体立刻涌入到试管中,试管中的红棕色气体颜色逐渐变为无色,仔细观察还可以看到前面剩余的铜片又开始与涌入试管中的液体发生缓慢的反应,产生一种无色的气体,经过相当长的时间后,试管中的液体又被压回烧杯中,而试管中充满了无色的气体。
根据你所学的知识对实验过程中产生的现象做出相应的解释:
(1)写出铜和浓硝酸反应的化学反应方程式,并根据现象(1)判断该反应是一个吸热反应还是放热反应。
(2)解释现象(2)中出现的打开K时烧杯中的液体立刻涌入到试管中中原因:
(3)用化学反应方程式解释现象(2)中剩余的铜片又开始与涌入试管中的液体发生缓慢的反应,产生一种无色的气体:
(4)若将实验后的试管在空气中打开,你认为将出现的实验现象是: 原因是:
(5)取反应后的烧杯中的液体3mL,并加入2mL、6mol/L的盐酸,最后加入足量的铜粉,写出对应的离子反应方程式:
四、计算题:
28、取一定量的碳酸钠、碳酸氢钠和硫酸钠的固体混合物与250mL、1.00mol/L的盐酸(过量)反应,得到标准状况下的CO2气体2.016L,然后加入500mL、0.1mol/L的氢氧化钡溶液,得到沉淀2.33克,溶液中过量的碱用10.0mL、1.00mol/L的盐酸恰好中和。通过计算求混合物中各物质的质量。
答案:1.B 2.B 3.D 4.A 5.C 6.C 7.B 8.C 9.C 10.C 11.C 12.B 13.D 14.C 15.A 16.A 17.B 18.D 19.B 20.D 21.C 22.D
23.C<D<B<A ,B>A>C>D
24.X:Cl Z: H 电子式为:略 Cl2+2KOK==KCl+KClO+H2O,2KClO3=2KCl+3O2
25.(1)滴酚酞的氨水(2)通SO2的品红27.略 28.Na2SO4为1.42g,在,碳酸氢钠1.68g,碳酸钠为7.42g