化 学 试 卷 (实验班)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试用时100分钟。
可能用到的相对原子质量:H-1 C—12 N—14 O-16 Na—23 S—32 Cl—35.5 Cu—64
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.关于粗盐提纯的下列说法正确的是
A. 溶解粗盐时,应多加水尽量使溶液稀些,防止食盐溶解不完全。
B. 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩。
C. 当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干。
D. 将制得的晶体转移到新制过滤器中用大量水进行洗涤。
2. 如图所示,下列实验操作与方法正确的是
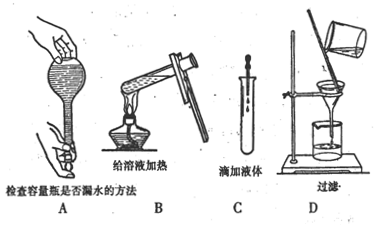
![]()
3.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为
A.2.5×1019个 B.2.5×1022个 C.5×1019个 D. 5×1022个
4.下列各组混合物可用分液漏斗分离的一组是
A.食用油和酒精 B.碘和四氯化碳 C.淀粉液和泥沙 D.汽油和水
5.有关化学实验的下列操作中,一般情况下不能相互接触的是
A. 过滤操作中,玻璃棒与三层滤纸
B. 过滤操作中,漏斗径与烧杯内壁
C. 分液操作中,分液漏斗径与烧杯内壁
D. 用胶头滴管向试管滴液体时,滴管尖端与试管内壁
6.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
7.胶体区别于其它分散系的本质特征是
A. 胶体粒子直径在1-100nm之间 B. 胶体粒子带电荷
C.胶体是一种介稳性的分散系 D. 光束通过胶体时有丁达尔效应
8.下列说法正确的是
A.物质的量是一个基本物理量,表示物质所含粒子的多少
B.1mol氢中含有2mol氢原子和2mol电子
C.1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数)
D.摩尔表示物质的量的数量单位
二、选择题:(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A. 150 mL 1 mol·L-1 NaCl溶液 B. 75 mL 1 mol·L-1 CaCl2溶液
C. 150 mL 2 mol·L-1 KCl溶液 D. 75 mL 1 mol ·L-1 AlCl3溶液
10.有关电解质的说法正确的是
A.纯水的导电性很差,所以水不是电解质
B.SO3水溶液的导电性很好,所以SO3是电解质
C.液态的铜导电性很好,所以铜是电解质
D.Na2O液态时能导电,所以Na2O是电解质
11.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+ 离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1 NA
12.在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a. CO2,100 mL;b. O2,200 mL;c. N2,400 mL;d. CH4,600 mL。则4个容器中气体的质量由大到小的顺序是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是
A.称量时NaOH已经潮解
B.向容量瓶中转移溶液时,瓶事先用蒸馏水洗涤过①①①②③
C.定容时俯视容量瓶的标线
D.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀
14.想一想:Ba(OH)2(液态)、CuSO4(固态)、纯CH3COOH这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
A.C2H5OH(aq) B.HCl(气态) C.水煤气 D.豆浆
15.能在溶液中大量共存且呈无色的是
A.Mg2+、SO42-、OH—、K+ B.Na+、Fe3+、H+、Cl—
C.H+、Cl—、NO3—、Ba2+ D.Ca2+、OH—、K+、NO3—
16.下列叙述正确的是
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液。
B.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L。
C. 将wg
a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液。
g水,得到2a%的NaCl溶液。
D. 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
17.能正确表示下列化学反应的离子方程式的是
A.澄清的石灰水与盐酸的反应 OH-+H+ = H2O
B.氧化铜与硝酸(aq)反应 O2— + 2H+ = H2O
C.硫酸镁(aq)与氢氧化钡(aq)混合 Ba2++SO42-=BaSO4↓
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2
18.某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=![]() c(Na+)=
c(Na+)=
c(SO42-)(c表示物质的量浓度),则其溶质可能是
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4 D.KCl、K2SO4、Na2SO4
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共25分)
19.(12分)(1)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、洗气、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
②除去H2中的CO2,可用 的方法除去。
③除去乙醇中溶解的微量食盐可采用 的方法。
④粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并
就可以得到较为纯净的氯化钠。
⑤除去氧化钙中的碳酸钙可用 的方法。
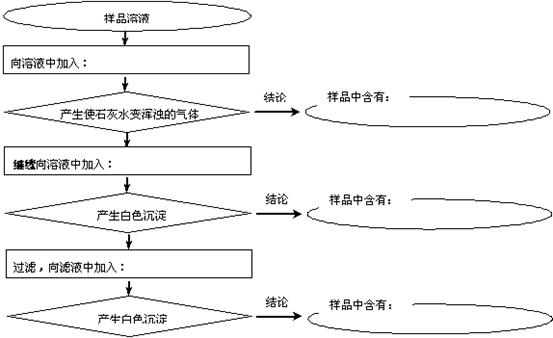 (2)某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验,请将所加试剂及有关结论填写在相应的空格中。
(2)某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验,请将所加试剂及有关结论填写在相应的空格中。
20.(13分)实验室用碳酸钠晶体配制1.00 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、 、 、 、 、
和 。
(2)本实验须称量碳酸钠晶体(Na2CO3•10H2O) g。
(3)容量瓶上标有 、 、 。
(4)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后直接倒进所选的且经检查不漏水的容量瓶中,洗涤烧杯2——3次,洗涤液也移至容量瓶中,然后加水至离刻度线2cm处,用滴管加水至刻度线。请指出上述操作中的3处错误:
①
②
③
四、(本题包括4题,共21分)
21.(5分)现有mg某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。则:
(1)该气体的物质的量为__________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_______________g·mol-1。
22.(8分)H2SO4的摩尔质量为 ,1.204×1024个H2SO4分子物质的量为 ,所含电子物质的量为 ,共含 个氧原子
23.(4分)写出下列反应的离子方程式:
(1)MgSO4(aq)与Ba(OH)2(aq)反应
(2)Fe(OH)3溶于稀硫酸
(3)CO2通入澄清的石灰水
(4)K2CO3(aq)与AgNO3(aq)反应
24.(4分)将下列离子方程式改写成化学方程式
(1)Fe3++3OH—==== Fe(OH)3↓
(2)Ba2++SO42-==== Ba SO4↓
(3 ) CO32-+2H+====CO2↑+H2O
(4)Fe2O3+6H+====2Fe3++3H2O
五、(本题包括2题,共30分)
25. (6分)将5.0LNaCl溶液和3.0LBaCl2溶液混和,设混和后总体积为8.0L,并测得NaCl物质的量浓度为0.50mol·L-1,BaCl2物质的量浓度为0.30mol·L-1。问:
(1)混合溶液中则Cl-物质的量浓度为多少?
(2)混和前NaCl溶液中NaCl的物质的量浓度为多少?
(3)混和前BaCl2溶液中BaCl2的物质的量浓度为多少?
26.(1)(2分)已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:
PbSO4+2CH3COONH4 =(CH3COO)2Pb+(NH4)2SO4。当醋酸铅溶液中通入H2S时,有黑色沉淀PbS和CH3COOH生成。表示这个反应离子方程式是
(2)(4分)已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| AgNO3 | Ba (NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
①上述四种物质能在水中发生的复分解反应为_________________________________;
②能在液氨中发生的复分解反应为_____________________________________。
(3)(4分)请把下面一些常用危险化学药品的标志贴在对应的化学药品瓶子上(在横线上写上编号即可)。
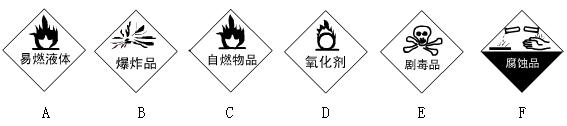
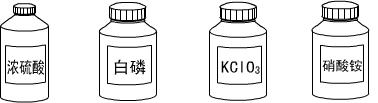
______ ______ ______ ______
(4)(8分)现有碳酸盐矿石(主要成分为CaCO3、BaCO3)需分离出BaCO3,并尽可能除去Ca2+,为完成此分离查得有关溶解度(克/100克水)数据如下:
|
物质 | 0℃ | 50℃ | 80℃ |
| Ca(OH)2 Ba(OH)2 | 0.173 1.64 | 0.130 13.1 | 0.004 101.5 |
分离要求:(1)原料只有矿石、焦炭、空气和水,不用其它化学原料;(2)Ca2+含量越低越好。下图是分离的实验步骤,在箭头上方注明反应所需条件、方法和所需的物质,在方框里写上各步产物的分子式或化学式。
![]()
(5)(6分)实验室欲配制6mol/L的硫酸溶液.现在三种不同浓度的硫酸:①240mL、1mol/L的硫酸 ②150mL25%(ρ=1.18g/cm3)的硫酸③18mol/L的H2SO4足量.还有三种规格的容量瓶:250mL、500mL、1000mL.配制要求:①②两种H2SO4全部用完,不足部分由③补充.问需选用哪种容量瓶?需用18mol/L浓H2SO4多少毫升?
答案:
1、C 2、A 3、A 4、D 5、D 6、B 7、A 8、C 9、BC 10、D 11、A
12、C 13、AD 14、B 15、C 16、D 17、AD 18、AC
19、⑴①过滤 ②洗气 ③蒸馏 ④过滤 蒸发 ⑤加热分解
⑵试剂:过量HNO3溶液、过量Ba(NO3)2溶液、少量AgNO3溶液
结论:Na2CO3、Na2SO4、NaCl
20、⑴托盘天平、烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管
⑵7.2 ⑶标线、温度、容量
⑷①不应直接倒入容量瓶中,而应用玻璃棒引流
②加水定容前,应先晃动容量瓶
③定容后应将容量瓶倒转摇匀
21、⑴![]() ⑵
⑵![]() ⑶
⑶![]() ⑷
⑷![]() ⑸
⑸![]()
22、98 g·mol-1、2 mol、100 mol、4.816×1024
23、⑴Mg2++SO42-+Ba2++2OH- = Mg(OH)2↓+BaSO4↓
⑵Fe(OH)3+3H+ = Fe3++3H2O
⑶CO2+Ca2++2OH- = CaCO3↓+ H2O
⑷2Ag++CO32- = Ag2CO3↓
24、⑴FeCl3+3KOH = Fe(OH)3↓+3KCl (其他正确答案也给分,下同)
⑵BaCl2+ Na2SO4 = BaSO4↓+ 2NaCl
⑶K2CO3 + 2HCl = 2KCl + CO2↑+H2O
⑷Fe2O3 + 6HNO3 = 2Fe(NO3)3+3H2O
25、⑴n(NaCl) = 0.50 mol·L-1×8.0 L = 4.0 mol,n(BaCl2) = 0.30 mol·L-1×8.0 L = 2.4 mol
![]()
⑵![]()
⑶![]()
26、⑴(CH3COO)2Pb + H2S = PbS↓ + 2CH3COOH
⑵①2AgNO3 + BaCl2 = 2AgCl↓ + Ba(NO3)2
②2AgCl+ Ba(NO3)2 = 2AgNO3 + BaCl2↓
⑶F、C、D、B
|
|
|
|
⑸①n1(H2SO4) = 0.24 L×1 mol·L-1= 0.24 mol
②n2(H2SO4) = ![]() = 0.45 mol
= 0.45 mol
n1(H2SO4) + n2(H2SO4) = 0.24 mol + 0.45 mol = 0.69 mol
用250 mL 容量瓶显然不行(①和②总体积已经超过250 mL)
若用500 mL 容量瓶,则n3(H2SO4) = 0.5 L×6 mol·L-1= 3 mol
还需H2SO4 :3 mol - 0.69 mol = 2.31 mol
需18mol·L-1H2SO4 V1 = ![]() = 0.13 L= 130
mL
= 0.13 L= 130
mL
①、②和③总体积已经超过500 mL
故只能选用1000 mL 容量瓶,n4(H2SO4) = 1 L×6 mol·L-1= 6 mol
还需H2SO4 :6 mol - 0.69 mol =5.31 mol
需18mol·L-1H2SO4 V2 = ![]() = 0.295 L= 295
mL
= 0.295 L= 295
mL