高一年级化学第一学期期中考试2
试卷
本试卷共五大题33小题,满分100分 考试时间 90分钟
出卷老师 钱承之 审卷老师 王文平
相对原子质量:Ar(Na)=23 Ar(C)=12 Ar(O)=12 Ar(H)=1
一、选择题(本题共15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.我国目前的能源结构中,占主要地位的是
A.石油和天然气 B.水力发电 C.核能 D.煤炭
2.据报导,某居民家庭将燃气热水器安装在不通风的浴室中,造成洗澡时不幸死亡事件。致人于死地的最可能的原因是
A.人缺氧窒息而死 B.燃气不完全燃烧产生的CO使人中毒而死
C.室内温度太高致人于死地 D.燃气管道突然漏气
3.发明“候氏制碱法”的化学家是
A.比利时人 B.中国人 C.法国人 D.英国人
4.7.8gNa2O2和6.2gNa2O分别放入甲、乙两个烧杯,再加入质量相同的足量的水,所得溶液的质量分数
A.甲=乙 B.甲>乙 C.甲<乙 D.无法确定
5.①稀盐酸和稀氢氧化钠溶液反应生成20g水时,放出Q1kJ的热量;②稀硝酸和稀氢氧化钡溶液反应生成20g水时,放出Q2kJ的热量。下列叙述正确的是
A.两反应的离子方程式相同,Q1>Q2 B.两反应的离子方程式不同,Q1<Q2
C.两反应的离子方程式相同,Q1=Q2 D.无法比较Q1和Q2的大小
6.下列各组反应,前者是氧化还原反应,后者是非氧化还原反应的是
A.实验室制取氧气;实验室制取氢气
B.生石灰CaO溶于水;二氧化碳通入石灰水中
C.实验室制取氢气;实验室制取二氧化碳
D.氢、氧混合气体爆鸣;液化石油气燃烧
7.根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
8.既能与氢氧化钠溶液反应,也能与盐酸反应的是
①MgCl2 ②NaHCO3 ③AgNO3 ④金属钠
A.只有②③④ B.只有①②③ C.只有②③ D.只有②
9.下列各种物质导电性最差的是
A.稀硫酸 B.澄清的石灰水 C.铁丝 D.固体食盐
10.黑火药的爆炸反应方程式可表示为:2KNO3+S+3C=K2S+N2↑+3CO2↑。其中氧化剂是
A.只有C B.只有KNO3 C.只有S D. KNO3和S
11.人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸制取氢气
C.利用高效催化剂和太阳能使海水分解产生氢气
D.由火力发电厂提供电力电解水产生氢气
12.在一定条件下,分别以加热高锰酸钾、过氧化钠与水反应的方法制取O2,若两者生成的O2的质量相同,则反应中转移的电子数之比为
A.1∶1 B.1∶2 C.2∶1 D.7∶4
13.含40gNaOH的溶液吸收35.2gCO2,所得溶液中CO32-和HCO3-的质量之比最接近于
A.1∶3 B.3∶1 C.2∶1 D.1∶2
14.(NH4)2Cr2O7是一种受热容易发生自身氧化还原反应而分解的盐,它的分解产物可能是
A.CrO3、NH3、H2O B.Cr2O3、NH3、H2O
C.CrO3、N2、H2O D.Cr2O3、N2、H2O
15.在下列反应中,Na2O2只表现出强氧化性的是
A.2Na2O2+2CO2=2Na2CO3+O2
B.Na2O2+MnO2=Na2MnO4
C.2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
D.5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2↑+8H2O
二、选择题(本题共10小题,每小题2分,共20分。每小题有一个或两个选项符合题意)
16.下列各组中的物质都是电解质的是
A.H2O、NH3·H2O、HNO3、CH3CH2OH B.HCl、NaBr、SO3、Na3PO4
C.CuSO4、NaOH、BaSO4、CH3COOH D.NH3、Na2CO3、BaSO4、NaI
17.下列离子方程式书写正确的是
A.硫酸铜溶液和氢氧化钠溶液混合 CuSO4+2OH-=Cu(OH)2+SO42-
B.稀硫酸滴在锌片上 Zn+2H+=Zn2++H2↑
C.小苏打与盐酸反应 CO32-+2H+=CO2↑+H2O
D.硫化氢通入氢氧化钠溶液 H2S+2OH-=S2-+2H2O
18.在2Na2O2+2CO2=2Na2CO3+O2的反应中,有关说法正确的是
A.Na2O2是氧化剂,CO2是还原剂 B.Na2O2既是氧化剂,又是还原剂
C.利用此反应,Na2O2可作为供氧剂 D.反应中转移了4个电子
19.下列变化过程表现为吸热的有
A.CaCO3分解 B.干冰用于舞台布景产生雾
C.稀硫酸与氢氧化钠溶液发生中和 D. 生石灰溶于水变成熟石灰
20.下列反应一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
21.下列变化中,需加入氧化剂的是
A.SO2→SO3 B.HCl→H2 C.FeCl2→FeCl3 D.Fe2O3→Fe
22.按金属活动性顺序由前到后分析,下列说法中正确的是
A.单质的还原性逐渐减弱 B.原子失电子能力逐渐增强
C.对应金属离子的氧化性逐渐增强 D.对应金属离子的得电子能力逐渐减弱
![]() 23.如图所示为一10mL量筒液面的位置,A与B、B与C刻度间相差1mL,若A为4.0,下列叙述中正确的是
23.如图所示为一10mL量筒液面的位置,A与B、B与C刻度间相差1mL,若A为4.0,下列叙述中正确的是
A.量筒中液体的体积为3.2mL
B.已从量筒中倒出液体6.8mL
C.仰视液面时,读取的数据大于3.2mL
D.俯视液面时,读取的数据大于3.2mL
24.具有下列现象的溶液可以肯定为酸性溶液的是
A.与活泼金属反应能放出氢气 B.不能使酚酞试液变红
C.能与NaHCO3溶液作用放出CO2 D.能与NaOH溶液反应
25. NaHCO3和NaOH的固体混合物40g置于密闭容器中充分加热后,排除气体冷却,混合物的质量为38.2g,则原混合物中NaHCO3的质量为
A.1.8g B.8.4g C.31.6g D.38.2g
|
|
|
|
|
|
27.(7分)根据反应:HgS+O2=Hg+SO2 ,回答下列问题:
(1)被氧化元素是__________,被还原元素是___________;
(2)反应中氧化剂是 ,还原剂是 ;
(3)标出电子得失的方向和数目(用双线桥法);
|
|
|
|
|
29.(4分)
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式;
(2)在上述中性溶液中,继续滴加Ba(OH)2溶液,写出发生反应的离子方程式。
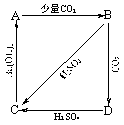 30.(4分)现有A、B、C、D四种物质的溶液,在进行焰色反应的实验时,透过蓝色钴玻璃观察到火焰的颜色为浅紫色,它们之间可按图示发生转化。由此可推断四种物质为:A___________,B___________,C___________,D__________。
30.(4分)现有A、B、C、D四种物质的溶液,在进行焰色反应的实验时,透过蓝色钴玻璃观察到火焰的颜色为浅紫色,它们之间可按图示发生转化。由此可推断四种物质为:A___________,B___________,C___________,D__________。
四、实验题(7分)
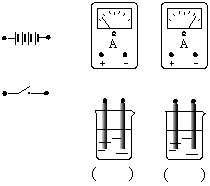 31.强电解质的溶液中只有电解质电离成的 ,没有 ;在水溶液里只有一部分分子电离成离子的电解质叫做
。
31.强电解质的溶液中只有电解质电离成的 ,没有 ;在水溶液里只有一部分分子电离成离子的电解质叫做
。
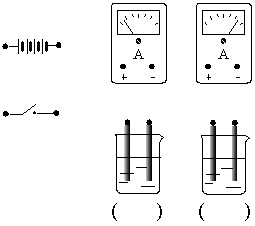
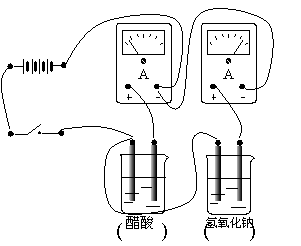
在图中两烧杯中分别盛有同浓度的氢氧化钠溶液和醋酸溶液,现要比较它们的导电能力的大小。请在右图中将各装置用导线连接起来以形成一完整的电路。若电路连接完成后,安培表的指针如图所示,请在烧杯下的括号内填入溶液中溶质的名称。
五、计算题(本题共2小题,共14分)
| 能 源 | 热 值 | 能源价格 |
| 电 | 3.6×106焦耳/千瓦时 | 0.50元/千瓦时 |
| 煤 | 2.52×107焦耳/千克 | 0.40元/千克 |
| 煤 气 | 4.68×107焦耳/米3 | 2.60元/米3 |
32.(6分)随着人们生活水平的不断提高,家庭厨房使用能源(燃料)的方式的日趋多样化。某市某小区的居民家中有使用电、煤饼和管道煤气等。有关电、管道煤气、煤的热值和价格如右表所示:
(1)据调查统计电器设备把电能转化成热能的利用率70%,煤饼炉的热能利用率约20%,管道煤气的热能利用率约40%,仅从取热考虑,请通过计算说明,选用哪一种能源(燃料)最经济?
(2)使用最经济燃料的缺点是什么?
33.(8分)已知:在一定温度下,在100g水中最多能溶解溶质的质量,叫做该溶质的“溶解度”,用符号“S”表示。例如:20℃时,S(CuSO4)=20g,表示在20℃时100g水中最多溶解20gCuSO4。
将一定量的金属钠投入到196g水中恰好得到t℃时240gNaOH饱和溶液,则t℃时NaOH的溶解度是多少?
第一学期期中考试
高一年级化学试卷答题纸
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
二、选择题
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
三、填空题
26.①___________________________②___________③__________④_______________________
⑤________________________⑥____________________________________________________
27.(1)_____________,______________;(2)____________,____________。
(3) HgS
+ O2![]() Hg + SO2 (4)_____________
Hg + SO2 (4)_____________
28.①____________②______________③_____________
④____________________________________________________________________________
⑤____________________________________________________________________________
29.(1)________________________________________,(2)___________________________
30.A________________,B_______________,C_______________,D________________。
四、实验题
31.__________,__________,___________。
五、计算题
32.
33.
第一学期期中考试
高一年级化学试卷答题纸
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | B | B | A | C | C | B | A | D | D | C | C | A | D | B |
二、选择题
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| C | BD | BC | AB | C | AC | AC | AD | C | B |
三、填空题
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
四、实验题
|
31.__________,__________,___________。
 |
五、计算题
32.解:(1)
电的单位人民币可利用热量(千焦/元)为:![]()
煤的单位人民币可利用热量(千焦/元)为:![]()
煤气的单位人民币可利用热量(千焦/元)为:![]()
使用煤最经济
(2)燃煤污染严重,废渣多,煤是重要化学化工原料,作为燃料经济效益低下。
33.设钠的质量为x
2Na——2H2O——2NaOH——H2
46 36 80 2
x ![]()
![]()
![]()
据题意:196g+x-![]() =240g x=46g 生成NaOH的质量:
=240g x=46g 生成NaOH的质量:![]() =46g×
=46g×![]() =80g
=80g
消耗水的质量:![]() =46g×
=46g×![]() =36g S(NaOH)=
=36g S(NaOH)=![]()
答:略