高一年级化学教学质量检测(模拟卷)
化学试题卷 (临安中学高一备课组)
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,上交试题卷和答题卷。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24 Al—27
Si—28 S—32 Ca—40
第Ⅰ卷(40分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1、原子在化学反应中,会发生变化的是 ( )
A. 质子数 B. 中子数 C. 电子数 D. 质量数
2、下列离子方程式不正确的是 ( )
A、碳酸氢钠溶液和烧碱混合 HCO3—+OH— == CO32—+H2O
B、金属钠投入水中2Na+2H2O == 2Na++2OH—+H2↑
C、CO2通入氯化钙溶液 CO2+Ca2++H2O == CaCO3↓+2H+
D、铁和稀硫酸反应Fe+2H+ == Fe2++H2↑
3、近一个时期,一些无知的人挖断通讯光缆想卖其中的贵金属挣钱。结果是既没有挣到钱却破坏了通讯设施,违反了国家法律。制造通讯光缆芯的材料是 ( )
A. 铜 B. 铁 C. 硅 D. 二氧化硅
4、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑(NaBH4中H元素为—1价),对于此反应,下列说法中正确的是 ( )
A.NaBH4既是氧化剂又是还原剂
B. NaBH4是还原剂,H2O是氧化剂
C. 硼元素被氧化,氢元素被还原
D. 被氧化的元素与被还原的元素质量比为2︰1
5、下列结论正确的是: ( )
(1)粒子半径:S2—>Cl > S >F (2)稳定性:HF>HCl>H2S>H2Te
(3)还原性:S2—>Cl—>Br—>I— (4)氧化性:Cl2>S>Se>Te
(5)酸性:H2SO4>HClO4>H2SO3 (6)非金属性:F>Cl>S>Se
A.(2)(4)(6) B.(1)(2)(3) C.(4)(5)(6) D.(2)(3)(6)
6、某原子中的电子由在K层上运动变为在M层上运动时,将 ( )
A.吸收能量 B.释放能量 C.能量不变 D.无法判断
7、下列无色透明溶液,能大量共存的是 ( )
A、H+、Cl—、Br—、K+、SiO32— B、K+、Cl—、Cu2+、SO42—、NO3—
C、K+、Na+、HCO3—、Ca2+ 、Cl— D、H+、K+、SO32—、Na+、Cl—
8、下列叙述正确的是 ( )
A.物质的量浓度相同的溶液中所含溶质的微粒数相同
B.氢氧根离子的摩尔质量是17克
C.在标准状况下,1摩尔SO3的体积约22.4升
D.0.1摩尔HCl气体约含6.02×1022个HCl分子
9、某元素原子核外M电子层的电子数与K层电子数相差5,则此元素在周期表中位于 ( )
A、第三周期第VA族 B、第二周期VA族
C、第三周期第VIIA族 D、第二周期第VIIA族
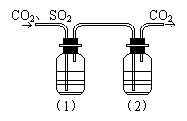 10、CO2气体中含少量SO2,欲得到干燥纯净的CO2,通过右图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是
( )
10、CO2气体中含少量SO2,欲得到干燥纯净的CO2,通过右图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是
( )
A.(1)NaOH (2)浓H2SO4
B.(1)浓H2SO4 (2)NaOH
C.(1)NaHCO3 (2)浓H2SO4
D.(1)浓H2SO4 (2)Na2CO3
11、为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾( KIO3)形式存在.已知在溶液中IO3—可和I —发生反应:IO3—+5I —+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3—.可供选用的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④淀粉、⑤ 食糖、⑥食醋、⑦白酒。进行上述实验时必须使用的物质是 ( )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
12、下列各组指定原子序数的元素,能形成AB2型离子化合物的是 ( )
A、6和8 B、16和8 C、12和9 D、11和17
13、饮用水的消毒剂有多种,其中杀菌能力强而且又不影响水质的是 ( )
A.臭氧 B. 漂白粉 C.过氧化钠 D.氯气
![]() 14、下列各微粒的图或式表示正确的是
( )
14、下列各微粒的图或式表示正确的是
( )
![]() A.HClO结构式:H—O—Cl B.MgBr2电子式:Mg2+ [︰Br︰]2—
A.HClO结构式:H—O—Cl B.MgBr2电子式:Mg2+ [︰Br︰]2—
|
C.Al3+离子结构示意图: D.NH3电子式:H︰N︰H
15、下列是某研究性学习小组对离子方程式xR2++yH++O2=mR3++nH2O的分析研究,在各种不同的说法中错误的是 ( )
A.可以根据电荷守恒,得出x与y的和一定等于m的结论
B.可以根据原子守恒,得出x和m的数值一定相等的结论
C.可以根据氧化还原反应中电子得失守恒,得出x的值等于4的结论
D.可以根据氧化还原反应中各种关系,得出R2+是还原剂、O2是氧化剂、 R3+是氧化产物、H2O是还原产物的结论
16、50mL18mol/L的浓硫酸与足量的铜片共热,被还原的H2SO4的物质的量是 ( )
A、0.9mol B、0.45mol C、1.8m01 D、小于0.45mol
17、有一瓶无色气体,可能含有HCl、CO2、H2S、HBr、和SO2中的一种或几种。将其能入氯水中,得到无色透明溶液。将溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;向另一份中加入HNO3酸化的AgNO3溶液,也有白色沉淀生成。以下结论正确的是 ( )
①原气体肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定无H2S和HBr ④不能确定原气体中是否有HCl ⑤原气体中肯定没有CO2 ⑥原气体中肯定有HCl
A.①②③ B.①③④ C.①③⑥ D.①③⑤⑥
18、下列说法正确的是 ( )
A、因为CO2通入水玻璃中可制取H2SiO3,说明H2CO3的酸性比H2SiO3强
B、因为SiO2和CaCO3固体混合加强热时,产生CO2气体,说明H2CO3的酸性比H2SiO3弱
C、SiO2既能溶于强碱溶液,又能和HF反应,故它是两性氧化物
D、因为玻璃中含SiO2,故玻璃试剂瓶不能盛装碱液
19、工业上从硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸。加入盐酸共热,硒酸被转化为亚硒酸(2HCl+H2SeO4==H2SeO3+Cl2+H2O),再将SO2通入亚硒酸的溶液中,单质硒即析出。下列叙述正确的是 ( )
A. H2SeO4的氧化性弱于Cl2
B. 亚硒酸氧化性强于亚硫酸
C. 亚硒酸的还原性强于亚硫酸
D. 析出1molSe需H2SeO3、SO2、H2O各1mol
20、过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫酸锰、水和氧气。如果过氧化氢中的氧原子是示踪原子(18O),当反应完成后,含有示踪原子的物质是 ( )
A. 氧气 B. 水 C. 硫酸锰 D. 硫酸钾
第Ⅱ卷(60分)
二、填空题(本大题共5小题,共25分)
21、(10分) 下面是元素周期表的一部分,针对①—⑩元素填写下列空白
| 主族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
(1)在这些元素中,属于金属元素的有________________(填元素符号)
(2)画出⑦元素原子结构示意图______________________________
(3)写出①和⑩形成的化合物的电子式_______________________
(4)用电子式表示④和⑥形成化合物的过程_____________________
(5)写出①和②的最低价形成气态分子的化学式__________________。
22、(5分)A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D、E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:用化学符号表示上述5种微粒:
A B C D E
23、(6分)原子序数大于4的主族元素A和B的离子Am+和Bn—它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为_______ ,
②A和B的核电荷数之差为______________(用含m、n的代数式表示)
③B和A的族序数之差为________________(用含m、n的代数式表示)
24、(4分)“碳族元素的化合价主要有+4和+2,碳、硅、锗、锡的+4价的化合物是稳定的,而铅的+2价的化合物是稳定的。”这句话实际上指出了铅的+4价化合物是不稳定的,容易转变为+2价的化合物。这里所说的+4价的铅的化合物“不稳定”并不是指其热稳定性(即加热是否容易分解),而是指+4价的铅的化合物具有较强的 性,如果向PbO2中加入浓盐酸,会产生黄绿色气体,写出该化学反应的化学方程式 。
25、在H2S、S、SO2、H2SO4中,硫元素只有氧化性的是______; 只有还原性的是_____;既有氧化性,又有还原性的是_________________。
三、实验题(本大题共3小题,共23分)
26、(7分)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答以下问题:
a.雨水样品的pH变化的原因(用化学方程式表示):
b.如果将刚取样的上述雨水和自来水混和,pH将变 。(填“大”、“小”、“不变”)原因(用化学方程式表示)
(2)你认为减少酸雨产生的途径可采用的措施是 。
①少用煤作燃料 ②把工厂烟囱造高 ③燃烧脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①②⑤ D.①③④⑤
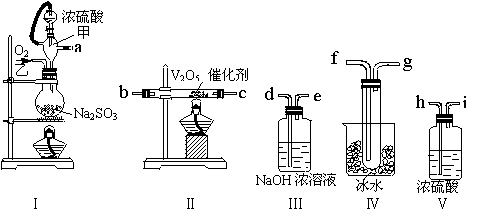 27、(8分)已知SO3是一种没有颜色的固体,熔点为16.8℃,沸点为44.8℃。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
27、(8分)已知SO3是一种没有颜色的固体,熔点为16.8℃,沸点为44.8℃。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体从左到右的方向是______→______→______→______→______→______→______→______ (填各接口的编号)
(2)实验时甲仪器的作用是 ,甲仪器具有该作用的原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________。
(4)Ⅳ处观察到的现象是______________________。
(5)用nmolNa2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重mg,则本实验中SO2的转化率为______________________________。
 28、(8分)右图是氢氧化钠试剂标签上的部分数据。两位同学欲测定该试剂是否为合格产品。
28、(8分)右图是氢氧化钠试剂标签上的部分数据。两位同学欲测定该试剂是否为合格产品。
(1)甲同学的做法是:
① 将2.00g该试剂溶于水配成250mL溶液,所需的主要仪器除玻璃棒、胶头滴管外,还须玻璃仪器有_____________、__________________。
② 取上述溶液25.00mL放入锥形瓶中,加几滴酚酞作指示剂,用0.20mol·L-1的标准盐酸滴定至终点(其它杂质不与盐酸反应,下同)。假定其它步骤都合理正确。请你分析根据消耗盐酸的体积__________(填“能”或“否”)测出NaOH的含量,说明理由:
__________________ ___________________。
(2)乙同学设计的实验方案是:
① 将2.00g该试剂溶于适量的水,加入足量的BaCl2溶液,充分反应后,过滤、洗涤,将洗涤液与滤液合并,再稀释到250mL。
② 取上述溶液25.00mL放入锥形瓶中,加几滴酚酞作指示剂,用 0.2000 mol·L-1的标准盐酸滴定至终点。若消耗标准盐酸的体积为24.70mL,该试剂是否为合格产品__________(填“合格”或“不合格”),氢氧化钠质量分数为 。
四、计算题(本大题共2小题,共12分)
29、(6分)完成下列基本计算:
(1)与16g氧气所含原子总数相同的氨气是 g。
(2)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为 。
(3)200mL 0.5mol/L盐酸与13.4g Na2CO3·xH2O恰好完全反应,则x的值为 。
30、(6分)SiO2和CaCO3的混合物26g,在高温下加热到质量不再改变,冷却后称质量为17.2g.
(1)写出可能发生反应的化学方程式;
(2)求产生的气体在标准状况时的体积;
(3)求原混合物中的SiO2的质量.
高一年级教学质量检测(模拟卷)
学校 班级 姓名 学号 座位号
| 题 序 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 |
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
二、简答题(本大题共5小题,共25分)
21.(1) (2) (3)
(4) (5)
22.(1) (2) (3) (4) (5)
23.(1) ;(2) (3)
24.(1) ; (2) 。
25.(1) (2) (3)
三、实验题(本大题共3小题,共23分)
26.(1)
(2)
27.(1)______→______→______→______→______→______→______→______
(2)
(3)
(4) (5)
28.(1)①_____________、__________________。
② 、 。
(2)② 、 。
四、计算题(本大题共2小题,共12分)
29.(1) (2) (3)
30.