高一年级教学质量检测化学试题卷
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,上交试题卷和答题卷。
可能用到的相对原子质量: H 1 Na 23 S 32 O 16 Mg 24 Cl 35.5
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1、人类使用材料的增多和变化,标志着人类文明的进步,下列材料与化学制备无关的是
(A)铁器 (B)石器 (C)青铜器 (D)合成材料
2、根据化学常识判断下列说法错误的是
(A)铅笔芯不是含有铅的笔芯 (B)加碘食盐不是加有I2的食盐
(C)碘酒不是含有的I2的酒精 (D)纯碱不是纯净的烧碱
3、化学反应都伴随着能量的变化,通常表现为热量的变化,以下叙述正确的是
(A)对于吸热反应,由于吸收热量后反应体系的温度升高
(B)对于吸热反应,生成物的总能量,高于反应物的总能量
(C)对于放热反应,放出热量后反应体系的温度降低
 (D)对于放热反应,生成物的总能量高于反应物的总能量
(D)对于放热反应,生成物的总能量高于反应物的总能量
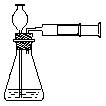
4、实验室实验时也可用推拉注射器活塞的方法检查右图中装置的气密性。当向外拉活塞时,如果装置气密性良好,可能观察到
(A)长颈漏斗下端口产生气泡 (B)瓶中液面明显上升
(C)长颈漏斗内的液面上升 (D)注射器内有液体
5、下列关于元素周期表的叙述正确的是
(A)元素周期表共有8个主族和8个副族
(B)同周期相邻的主族元素,在周期表中一定处于相邻的纵行
(C)元素周期表共有三个短周期和四个长周期
(D元素周期表的第8、9、10纵行中的所有元素均为同族元素
6、2003年月12月3日广东省对佛山、江门两地的鱼翅、开心果的加工企业进行执法检查,查获用工业双氧水加工过的鱼翅成品和开心果等食品。食用工业双氧水加工的食品会致癌致畸形。不法厂家用工业双氧水加工鱼翅和开心果使其增白是利用H2O2的
(A)不稳定性 (B)强氧化性 (C)还原性 (D)弱酸性
7、下列物质中含有非极性共价键的是
(A)NaOH (B)Na2O (C)Na2O2 (D)CaCl2
8、新型无机非金属材料与传统无机非金属材料的共同特性是
(A) 耐高温 (B)具有电学特性
(C)具有光学特性 (D)具有生物功能
9、下列变化过程,需吸热的是
(A)H + H → H2 (B)H + Cl → HCl (C)I2→I + I (D) S + O2==SO2
10、1mol铜和1mol碳分别和足量浓硫酸反应,下列叙述正确的是
(A)消耗的硫酸的量相同 (B)反应产生的气体成分相同
(C)被还原的硫酸的物质的量相同 (D)转移的电子的物质的量相同
11、含元素硒(Se)的保健品已开始进入市埸,已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中不正确的是
(A)原子序数为24 (B)最高价氧化物的化学式为SeO3
(C)非金属性比溴弱 (D)气态氢化物化学式为H2Se
12、我们平常所说的某种元素的相对原子质量,是按各种天然同位素原子所占的一定百分比算出的平均值,则下列叙述正确的是
(A)这里所说的“百分比”,是指各天然同位素原子所占的质量分数
(B)这里所说的“元素的相对原子质量”,就是各同位素原子的质量和12C质量的1/12的比值
(C)这里所说的“同位素原子”,就是指质子数相同而中子数不同的原子
(D)这里所说的“平均值”,就是指各同位素原子的相对原子质量相加后除以该元素同位素的种数所得的值
13、二氧化硅是一种酸性氧化物,下列物质中不能和二氧化硅发生化学反应的是
(A)氢氟酸 (B)碳(高温下) (C) 碳酸钠(高温下) (D)水
14、下列物质放在敞口容器中久置,其质量会减少的是
(A)浓硫酸 (B)固体苛性钠 (C)过氧化钠 (D)十水碳酸钠晶 体
15、含6.02×1023个中子的73Li的质量约是
(A) 4/7 g (B) 4.7g (C) 7.4g (D)7/4 g
16、下列有关反应离子方程式错误的是
(A)KOH溶液与过量的SO2反应: OH-+SO2==HSO3-
(B)Na2SO3溶液与稀硫酸反应 SO32-+2H+==SO2↑+H2O
(C)NaBr溶液中通入氯气:2Br-+Cl2==Br2+2Cl-
(D)石灰石与盐酸反应:CO32-+2H+==H2O+CO2↑
17、下列工业生产中不会产生大量二氧化碳的是
(A) 用碳和二氧化硅制粗硅 (B)制玻璃 (C) 制水泥 (D)烧制生石灰
18、过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫酸锰、水和氧气,如果过氧化氢中的氧原子是18O,在反应过程中,含18O原子的生成物是
(A)硫酸钾 (B)水 (C)硫酸锰 (D)氧气
19、向盛有NaHSO4溶液的烧杯中不断滴入Ba(OH)2溶液,随着Ba(OH)2溶液的不断滴入,溶液中产生的沉淀量与溶液的pH变化情况正确的是
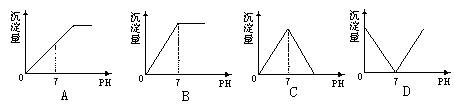
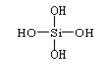 20、两个原硅酸分子通过分子内的氢氧原子团相互间脱去一分子的水形成 H6Si2O7,反应式为2H4SiO4==H6Si2O7+H2O,原硅酸结构可用右图表示 ,若有n个原硅酸分子以这种方式脱去n-1个水分子后形成H(2n+2)SinO(3n+1)中,含有的硅氧键的数目是
20、两个原硅酸分子通过分子内的氢氧原子团相互间脱去一分子的水形成 H6Si2O7,反应式为2H4SiO4==H6Si2O7+H2O,原硅酸结构可用右图表示 ,若有n个原硅酸分子以这种方式脱去n-1个水分子后形成H(2n+2)SinO(3n+1)中,含有的硅氧键的数目是
(A)4n (B) 3n (C)3n+2 (D) 4n-2
二、简答题(本大题共5小题,共33分)
21、(6分)用化学用语回答下列问题
(1)画出S2-的原子结构示意图: ▲ 。
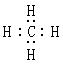
(2)写出甲烷分子的电子式: ▲ 。
(3)用电子式表示氧化钾的形成过程: ▲ 。
22、(8分)几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
分析图中有关数据,回答下列问题(用该元素的真实元素符号来表示):
(1)L、R的单质与稀盐酸反应速率 ▲ > ▲ 。
(2)M与T形成的化合物能否和氢氧化钠溶液反应? ▲
(3)Q、T两种原子比较,电子层数 ▲ 比 ▲ 多。
(4)以上元素形成的简单离子,核外电子数相等的是 ▲ 。
23、(8分)利用化学变化的递变规律,常可对某些物质的化学性质作出合理的推测,请判断下列各小题的推测是否合理,并说明判断的理由。
(1)已知红热的铜丝能在氯气中燃烧,推测红热的铁丝也能在氯气中燃烧。
(2)已知铁粉和硫粉加热条件下能发生反应,推测铜粉和硫粉在相同加热条件下也一定能发生反应。
(3)从二氧化硫通入Ba(OH)2溶液能产生白色沉淀的事实,推测二氧化硫通入BaCl2溶液也能产生白色沉淀。
(4)从2CO2+2Na2O2==2Na2CO3+O2↑的反应,推测二氧化硫也一定能发生反应:2SO2+2Na2O2==2Na2SO3+O2↑
24、(4分)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3溶液吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2和水蒸气的副产品。试写出上述两步反应的化学方程式:
第一步:_______▲______;第二步:_________▲_______。
25、(7分)据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是: ▲
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
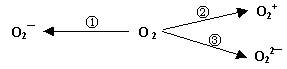 (2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, ▲ (填序号)相当于氧分子的氧化; ▲ (填序号)相当于氧分子的还原。
(3)写出O22—的电子式: ▲
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式: ▲
三、实验题(本大题共3小题,共15分)
26、(4分)浓硫酸与铜的反应用了下图所示的装置,请回答下列问题。
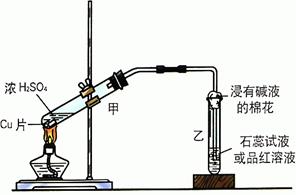 (1)若试管乙中装的是石蕊试液,则反应过程中观察到的现象是 ▲ ;
(1)若试管乙中装的是石蕊试液,则反应过程中观察到的现象是 ▲ ;
(2)若试管乙中装的是品红溶液,则反应过程中观察到的现象是 ▲ ;
(3)反应结束后在试管甲的底部常可见到一些白色固体,该固体是可能是 ▲ (填化学式);
(4)待试管甲内液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色。这一步操作的目的是要证实 ▲ 。
27、(4分)为了测定不同电解质的水溶液的导电能力是否相同,设计如下图所示的实验,
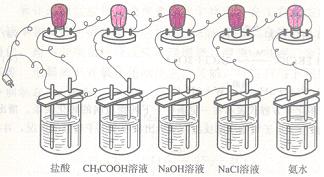
请回答下列问题:
(1)本实验取了盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液和氨水五种溶液,若要再增加一种溶液,你认为选取下列哪种溶液最为合适? ▲
(A)硫酸钠 (B)氯化钙 (C)氢氧化钡 (D)硝酸钾
(2)为了排除无关因素的干扰,本实验应控制多种实验条件,如烧杯的规格相同、烧杯内溶液的体积相等、相同的电极材料、各电极间的距离相等、溶液的温度相同等,除此外,你认为还应控制的最关键的条件(或因素)是 ▲ 。
(3)本实验通过观察到 ▲ 现象,间接说明不同电解质溶液导电能力是不同的。
(4)通过本实验,证实了不同的电解质溶液导电能力是不同的,从而可直接推出的结论是 ▲ 。
28、(7分)实验室可用单分子膜法测定阿伏加德罗常数,其步骤和原理如下:
(一)配制一定物质的量浓度的硬脂酸的苯溶液(硬脂酸是一种不溶于水的有机弱酸,苯是一种易挥发的有机溶剂)
(二)测定从胶头滴管滴出的每滴液体的体积
 (三)测定在水槽水面上形成硬脂酸单分子膜所需硬脂酸苯溶液的滴数(见下图)
(三)测定在水槽水面上形成硬脂酸单分子膜所需硬脂酸苯溶液的滴数(见下图)
用胶头滴管吸取硬脂酸的苯溶液,垂直往水面中滴一滴,待苯在水面上全部挥发,硬脂酸分子在水面上扩散至看不到油珠时,再滴第二滴,如此逐滴滴下,直至整个水面形成单个分子厚度的硬脂酸分子形成的膜为止。(该单分子膜分子是紧密排列的,此时如再滴入硬脂酸溶液,该溶液在水面上不再扩散)
(四)测量水槽中水的表面积
(五)计算求得阿伏加德罗常数
请回答下列问题:
(1)在第一步实验中,称取一定质量的硬脂酸后,配制溶液所需的玻璃仪器主要有
▲ 、 ▲ 、 ▲ 、 ▲ 。
(2)第二步实验,测定从胶头滴管滴出的每滴液体的体积,常用的方法是 ▲ 。
(3)若硬脂酸苯溶液的浓度为c mol·L-1;测得胶头滴管滴出的每滴溶液的体积为V mL;水面上形成硬脂酸单分子膜时滴下的硬脂酸溶液的滴数为d;水槽中水的表面积为S cm2;每个硬脂酸分子的截面积为A cm2,求阿伏加德罗常数NA(用含c、V、d、S、A的代数式表示)。 ▲
(4)若水中含有少量氢氧化钠溶液,则会对测定的NA值有何影响? ▲ (选填“偏大”、“偏小”或“无影响”)
四、计算题(本大题共2小题,共14分)
29、(6分)完成下列基本计算:
(1) 0.2mol某物质的质量为12.8g,该物质的摩尔质量为____▲____g/mol。
(2) 质量分数为36.5%的盐酸(密度为1.19 g·cm-3),该溶液的物质的量浓度为____▲___mol/L。
(3) 3.1gNa2O恰好与50mL硫酸溶液完全反应,该溶液中H2SO4的物质的量浓度为__▲____mol·L-1。反应后生成Na2SO4____▲____g。
30、(6分)8.1 克某单质A能和一定量的盐酸中置换出0.9 克H2,同时生成ACl3;另一种元素B,它的气态氢化物化学式为H2B,在B的最高价氧化物中,B的质量分数为40%。
(1) 计算A、B两种元素的相对原子质量,写出相应的元素符号。
(2) 写出A、B反应的化学方程式(用相应的元素符号表示),并标明电子转移的方向和数目。
高一年级教学质量检测
化学试题参考答案及评分标准
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | B | C | B | A | D | B | C | A | C | A |
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 | A | C | D | D | D | D | A | D | A | A |
 二、简答题(本大题共5小题,共33分)
二、简答题(本大题共5小题,共33分)
21、(6分)
(1) ![]() (2分) (2)
(2分)
(2分) (2)
(2分)
(3) (2分)
22、(8分)(1)Mg;Be (2)能 (3)S;O (4)Mg2+,Al3+,O2-
(写出一个给1分)
23、(8分)
(1)合理;因为铁的还原性比铜强。
(2)不合理;因为铜的还原性比铁弱。
(3)不合理;因为二氧化硫通入氢氧化钡溶液产生白色沉淀的原因是,SO2+2OH-=SO32-+H2O,然后Ba2++SO32-==BaSO3↓,而氯化钡溶液不存在和二氧化硫反应的大量的OH-。(其它合理的解释也可给分)
(4)不合理(或不一定合理);因为二氧化硫有还原性,过氧化钠有强氧化性,过氧化钠可能会将二氧化硫氧化。
(以上各小题中判断的结论正确各给1分,说明的理由正确再各给1分)
24、(4分)Na2SO3+SO2+H2O=2NaHSO3 2NaHSO3=Na2SO3+SO2↑+H2O (各2分)
![]() 25、(7分)(1)C、D (2)②;①③ (3) (4)KO2(其它合理的化学式也同样给分) (各1分,共7分)
25、(7分)(1)C、D (2)②;①③ (3) (4)KO2(其它合理的化学式也同样给分) (各1分,共7分)
三、实验题(本大题共3小题,共15分)
26、(4分)(1)石蕊试液变红 (2)品红溶液褪色 (3)CuSO4 (4)证实溶液中有Cu2+存在。 (每空1分,共4分)
27、(4分)(1)D (2)五种溶液的物质的量浓度相同 (3)灯光亮度不一 (4)不同电解质在水中的电离程度是不同的。(每空1分,共4分)
28、(7分)(1)容量瓶、烧杯、滴管、玻棒 (各1分,共4分)
(2)往小量筒中滴入1 mL溶液,然后记下总滴数,计算出1滴溶液的体积 (1分)
(3)![]() (1分) (4)偏小(1分)
(1分) (4)偏小(1分)
四、计算题(本大题共2小题,共12分)
29、(6分)(1)64 (2)11.9 (3) 1;7.1 (每小题各2分,共6分)
30、(6分)
(1) 2A +6HCl == 2ACl3 + 3H2↑ (1分)
n(H2)==0.9g/2g·mol-1 =0.45mol ,n(A)== 0.45mol×2/3=0.3mol
M(A)==8.1g/0.3mol==27g·mol-1。Mr(A)=27;A元素为Al。(1分)
从B的气态氢化物分子式H2B可推出B的最高价氧化物为BO3。(1分)
由题意:
Mr(B)/ Mr(BO3)=40%,Mr(B)/ [Mr(B)+48]=0.4,Mr(B)=32;B元素为S。(1分)
![]() (2)
(2)
(化学方程式1分,电子转移的方向和数目全对给1分)