![]()
|
|
学科:化学 |
| 教学内容: 高一化学第二章达纲检测(B卷) |
【同步达纲练习】
一、选择题
1.关于钠的叙述错误的是( )
A.硬度小,可用小刀切割 B.常温是固体,所以熔点很高
C.是银白色具有金属光泽的单质 D.钠在自然界分布很广,既有游态态又有化合态
2.下列物质的俗名与其化学式、用途都相符的是( )
A.烧碱Na2CO3制玻璃 B.小苏打NaHCO3治疗胃酸过多
C.苏打NaOH造纸 D.食盐NaCl化肥
3.钠与水反应现象,与钠的下列性质有关的是( )
A.钠是热和电的良导体 B.钠的密度小
C.钠的硬度小 D.钠的熔点低
4.下列物质放在空气中,因为发生氧化还原反应而变质的是( )
A.Na B.NaOH C.NaCl D.Na2O2
5.下列物质中热稳定性最差的是( )
A.CaCO3 B.Na2CO3 C.NaHCO3 D.NaOH
6.金属钠的用途:①还原某些金属 ②做高压钠灯 ③制过氧化钠 ④与钾混合作原子反应堆的导热剂.其中利用钠的物理性质的是( )
A.①② B.①③ C.②④ D.④
7.下列反应的离子方程式错误的是( )
A.小苏打与盐酸反应HCO3-+H+![]() CO2↑+H2O
CO2↑+H2O
B.碳酸氢钙与足量氢氧化钠溶液反应Ca2++2HCO3-+OH-![]() CaCO3↓+H2O+HCO3-
CaCO3↓+H2O+HCO3-
C.钾与水反应K+2H2O![]() K++2OH-+H2↑
K++2OH-+H2↑
D.氢氧化钠与三氯化铁溶液反应Fe3++3OH-![]() Fe(OH)3↓
Fe(OH)3↓
8.下列说法不正确的是( )
A.Na2CO3比NaHCO3易溶于水
B.NaHCO3比Na2CO3稳定(受热时)
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.NaHCO3可与盐酸反应而Na2CO3不行
9.下列溶液中溶质质量分数最大的是( )
A.4.6g钠投入45.4g水中 B.6.2gNa2O投入43.8g水中
C.7.8gNa2O2投入42.2g水中 D.8gNaOH投入42g水中
10.在Na2O2与CO2的反应中,氧化剂与还原剂的质量比是( )
A.1∶1 B.2∶1 C.1∶2 D.8∶53
11.下列物质中不能与CO2反应的有( )
A.KHCO3 B.Na2O2 C.Na2CO3 D.NaOH
12.下列各组微粒的还原性由强到弱的顺序是( )
A.Cs+、Rb+、K+、Na+、Li+ B.Cs、Rb、K、Na、Li
C.Li、Na、K、Rb、Cs D.Li+、Na+、K+、Rb、Cs
13.加热4.2g小苏打,直到再没有气体放出为止,剩余固体物质的质量为( )
A.1.68g B.2.65g C.3.36g D.5.3g
14.下列物质与水反应时,既表现氧化性又表现还原性的是( )
A.金属钠 B.氧化钠 C.过氧化钠 D.二氧化碳
15.下列物质的溶液,能和小苏打反应,且既无气体也无沉淀产生的是( )
A.苏打 B.盐酸 C.熟石灰 D.烧碱
16.在天平两边各放一个相同质量的烧杯,分别加入100gH2O,向左盘烧杯中加入4.6g金属钠,为了保持天平指针指向零点,应向右盘加入金属钾的质量为( )
A.3.90g B.4.52g C.5.12g D.7.80g
17.下列说法不正确的是( )
①除去CO中混有的CO2,可让气体通过Na2O2粉末②不慎将浓NaOH液沾在皮肤上,应立即用H2SO4溶液冲洗③碱金属在氧气中燃烧,都得到R2O2④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用
A.只有① B.只有②③
C.只有①③ D.①②③④
18.将下列各组溶液进行混合,有白色沉淀生成,加入过量稀硝酸,沉淀消失并放出气体,再加AgNO3溶液又生成白色沉淀,则该组溶液是( )
A.Na2CO3和MgBr2 B.Ba(OH)2和K2SO4
C.Ba(OH)2和(NH4)2SO4 D.Na2CO3和CaCl2
19.根据下列反应:W![]() X+CO2↑+H2O;Z+CO2→X+O2↑;Z+H2O→Y+O2↑,判断W、X、Y、Z应分别依次是( )
X+CO2↑+H2O;Z+CO2→X+O2↑;Z+H2O→Y+O2↑,判断W、X、Y、Z应分别依次是( )
A.Na2CO3、NaHCO3、NaOH、Na2O2 B.KHCO3、K2CO3、KOH、K2O2
C.Ca(HCO3)2、Na2CO3、NaOH、Na2O2 D.Ca(HCO3)2、CaCO3、Ca(OH)2、CaO
20.将10LCO2和水蒸气的混合气体通过Na2O2,结果气体体积变成6L(均为标准状况下的体积),则参加反应的Na2O2的质量为( )
A.48.6g B.27.9g C.12g D.无法确定
二、填空题
21.碱金属单质中密度最小的是 ,熔点最低的是 ,金属性最强的是 .
22.把金属钾投入CuCl2溶液中,可以看到的现象是 ,反应的化学方程式是 .
23.过氧化钠和二氧化碳反应的化学方程式为 ,还原剂为 ,这个反应应用于制造 .
24.某化合物的焰色反应为黄色,该化合物溶于水能放出一种使带火星的木条复燃的气体,所得的溶液能使酚酞试液变红,该物质是 ,它溶于水的反应方程式为 .
25.完成下列化学方程式,是离子反应的只写离子方程式.
①单质Na投入小苏打溶液中:
②金属钠投入CuSO4溶液中:
③过氧化钾与CO2反应:
④Ba(OH)2溶液与(NH4)2SO4溶液混合加热:
26.现有KHCO3和CaCO3的混合物及与之等质量的NaHCO3,分别与等质量分数的盐酸反应,消耗酸的质量相同,则混合物中KHCO3与CaCO3的质量比为 .
27.将金属钾投入CuSO4溶液中,有时会看到黑色沉淀现象,试用化学方程式及必要的文字说明原因: .
28.有一种白色粉末装物质A,将其分为质量相等的两份:取其中一份加热分解得到能使澄清石灰水变浑浊的气体B和残余物C,用另一份加入足量盐酸,也会产生气体B,但产生气体的量是上述的两倍,气体B跟一种淡黄色粉末状物质D反应,产生无色无臭的气体单质E,同时又得到C,再取少量A进行焰色反应,火焰呈黄色,则各物质的化学式为:A ;B ;C ;D ;E ;有关反应的化学方程式为:① ;② ;③ ;④ .
三、实验题
29.为证明有关物质的性质,某学生设计了下图所示装置.当打开活塞C,使液体A与搁板H上的块状固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮.
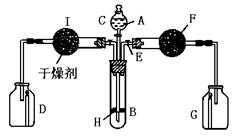
(1)请写出装置中有关仪器内盛放的物质:A ,B ,F ;
(2)用化学方程式表示上述实验中发生的有关反应 ;
; .
四、计算题
30.在一定条件下,NO跟NH3可发生反应生成N2和H2O.现有NO和NH3的混合物20.9g,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g.
①写出反应的化学方程式并标出电子转移的方向和数目.
②若以上反应进行完全,计算反应混合物中NO与NH3的质量各是多少?
31.已知NaOH固体中混有少量NaHCO3固体,取一定量这种固体在密闭容器中加热到250℃左右,待充分反应后冷却至室温,将残留固体溶于水后取1/10该溶液,加入10%的稀H2SO426.95g,恰好完全反应,并得到0.22gCO2气体.求该固体混合物中NaOH的质量分数.
32.在100℃时,3.88g气体X与足量的Na2O2充分反应,放出一定量的O2,且固体质量增加了2.28g.求:
①X是何种气体?
②其质量是多少?

参考答案
【同步达纲练习】
一、1.BD 2.B 3.BD 4.AD 5.C 6.C 7.BC 8.BD 9.C 10.A 11.A 12.B 13.B 14.C 15.D 16.B 17.D 18.D 19.B 20.B
二、21.锂;铯;铯 22.即钾成小球浮于液面上,迅速向各个方向游动,溶液中出现蓝色沉淀;2K+2H2O=2KOH+H2↑ 2KOH+CuCl=2KCl+Cu(OH)2↓ 23.2Na2O2+2CO2=2Na2CO3+O2 Na2O2 供氧剂 24.Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 25.①2Na+2HCO3-=2Na++2CO32-+H2↑ ②2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑ ③2K2O2+2CO2=2K2CO3+O2↑ ④Ba2++2OH-+2NH4++SO42-![]() BaSO4↓+2NH3↑+2H2O 26.4∶17 27.2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑ 该反应放热,促使Cu(OH)2
BaSO4↓+2NH3↑+2H2O 26.4∶17 27.2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑ 该反应放热,促使Cu(OH)2![]() CuO+H2O 28.A:NaHCO3 B:CO2 C:Na2CO3 D:Na2O2 E:O2 ①2NaHCO3
CuO+H2O 28.A:NaHCO3 B:CO2 C:Na2CO3 D:Na2O2 E:O2 ①2NaHCO3![]() Na2CO3+CO2↑+H2O ②CO2+Ca(OH)2=CaCO3↓+H2O ③NaHCO3+HCl=NaCl+H2O+CO2↑ ④2Na2O2+2CO2=2Na2CO3+O2
Na2CO3+CO2↑+H2O ②CO2+Ca(OH)2=CaCO3↓+H2O ③NaHCO3+HCl=NaCl+H2O+CO2↑ ④2Na2O2+2CO2=2Na2CO3+O2
三、29.解析:该装置的左半部的现象和反应实际上是提示:A与B反应产生的气体是不助然的,是CO2,由此可知A是稀盐酸,B可选用块状大理石(CaCO3).从装置右边的实验现象可判断,未经干燥的CO2和F发生反应,产生一种助燃的气体,即氧气,则F可能是Na2O2,产物和反应物确定后,写出有关反应方程式就不难了.
答案:稀盐酸,CaCO3,Na2O2;CaCO3+2HCl=CaCl2+H2O+CO2↑
2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2H2O=4NaOH+O2↑
四、30.①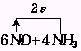 =5N2+6H2O
=5N2+6H2O
②NO:9g NH3:11.9g
31.82.6%
32.①气体x为CO2与水蒸气的混合气体
②CO2:3.52g H2O:0.36g
