高一化学下学期期末考试试卷(A)
命题:江西吉安一中 胡金华
本试卷分I卷和Ⅱ卷两部分。第Ⅰ卷为选择题,本卷考试时间:100分钟, 满分:100分。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Ca-40 K-39 Cu-64 Fe-56 S-32 Zn—65
Na—23 Mg—24 Ba—137
第I卷(选择题 共48分)
一.选择题(本题有16小题,每题3分,共48分,每小题只有一个选项符合题意)
1.人们把食品分为绿色食品.蓝色食品.白色食品等。绿色植物通过光合作用转化的食品叫做绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品。下面属于白色食品的是 ( )
A.食醋 B.面粉 C.菜油 D.海带
2.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象 ( )
A.![]()
![]()
![]() B.
B.![]()
![]()
![]()
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
3.下列各组性质比较正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Al(OH)3
③氧化性:N>P>F ④还原性:HCl<H2S<SiH4
A.①②④ B.②③④
C.①②③ D.①③④
4.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.下列对浓H2SO4的叙述正确的是 ( )
A.常温下,浓H2SO4与铁.铝不反应,所以铁质.铝质容器能盛放浓H2SO4
B.浓H2SO4具有吸水性,能使蔗糖炭化
C.浓H2SO4和铜片加热既表现出酸性,又表现出强氧化性
D.浓H2SO4与亚硫酸钠反应制SO2时,浓H2SO4表现出强氧化性
6.等体积硫酸铝.硫酸锌.硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为( )
A.1:2:3 B.1:6:9
C.1:3:3 D.1:3:6
7.下列反应中,调节反应物的用量或物质的量浓度,不会改变反应产物的是( )
A.碳在氧气中燃烧 B.铁丝在硫蒸气中燃烧
C.二氧化硫通入石灰水 D.硫酸中加入锌粉
8.下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A.H2O B.BF3 C.CCl4 D.PCl5
9.既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是( )
A.Al3+.Na+.NO3— .Cl— B.K+.Na+.Cl—.NO3—
C.K+.Na+.Cl—.SO32— D.K+.Na+.I—.Fe2+
10.工业上从含硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸(H2SeO3)和少量硒酸(H2SeO4),再加入盐酸共热,硒酸被转化为亚硒酸,反应方程式为2HCl+H2SeO4=H2SeO3+Cl2+H2O,然后再将SO2通入亚硒酸中,单质硒析出。据此,判断下列叙述中正确的是 ( )
A.H2SeO4氧化性弱于Cl2 B.H2SeO3氧化性强于H2SO3
C.H2SeO3氧化性弱于SO2 D.析出1molSe需H2SeO3.SO2.H2O各1mol
11.1999年曾报导合成分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是 ( )
A.N5+共有34个核外电子
B.N5+中氮—氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1
D.化合物N5AsF6中F化合价为—1
12.x.y.z是三种主族元素,如果xm+与yn—具有相同的电子层结构,zn—半径大于yn—半径,则三种元素的原子序数由大到小的顺序是 ( )
A.z >x>y B.x>y>z
C.z>y>x D.x>z>y
13.在50mlAl2(SO4)3溶液中,加入Cl—离子浓度为0.8mol·L—1的BaCl2溶液75ml,恰好使SO42—离子完全变成沉淀,则Al2(SO4)3溶液中Al3+离子的物质的量浓度为( )
A.0.6mol·L—1 B.0.4mol·L—1
C.0.3mol·L—1 D.0.2mol/L
14.下列说法正确的是 ( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
15.对某酸性溶液(可能含有I-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入溴水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是 ( )
A.I- B.SO42-
C.H2SO3 D.NH4+
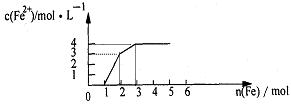
16.某稀溶液中含有Fe(NO3)3 .Cu(NO3)2 .HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3.Cu(NO3)2.HNO3物质的量浓度之比为 ( )
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第II卷 (非选择题 共52分)
三.实验题(本题包括2小题,每空1分,共18分)
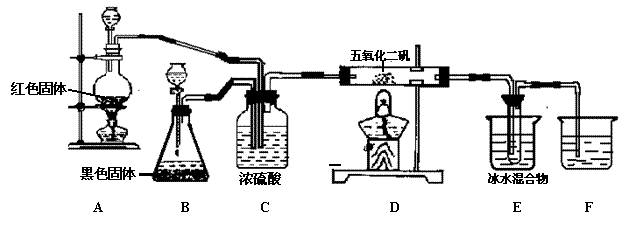
17.(9分)实验室合成SO3的装置如图;试回答
(1)装置B中的黑色固体是:
(2)装置C的作用:
① ;
② ;
③ 。
(3)A处反应的化学方程式: (2分)
D处反应的化学方程式: (2分)
(4)E中冰水混合物的作用是
17.(9分)某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,设计如下方案:
| 操 作 | 结 论 | |
| 甲 | 火柴梗 | 变黑者为浓硫酸 |
| 乙 | 加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 丁 | 用玻璃棒蘸浓氨水靠近盛酸的瓶口 | 冒白烟者为浓梳酸 |
| 戊 | 加到CuSO4·5H2O晶体中 | 变白者为浓硫酸 |
(1)其中可行的是 。
(2)其中一个稍作改进就能成为可行的是 ,改进方法是 。
(3)完全错误的是 ,因为 。
(4)请给出另外两种鉴别方法
| 操 作 | 根据现象做出结论 | |
| A. | ||
| B. |
四.填空题(本题包括4小题 每空1分,共25分)
18.( 7 分)下表是元素周期表的主族和零族部分,请用相应的化学用语回答有关问题:(用相应化学符号填写,下同)
| 主族 周期 | ⅢA | 0 | ||||||
| 1 | ||||||||
| 2 | A | B | ||||||
| C | D | E | ||||||
| F | G | H | ||||||
| 5 | J |
⑴A.B的气态氢化物的稳定性是 > 。
⑵A.B.C.D的离子半径由大到小的顺序
⑶若E的原子序数为m,则A的原子序数是 ,H的原子序数是 。
(4)A~J所有元素中,两两相互结合成原子个数比为1∶2的离子化合物的化学式是 。(2分)
19.(6分)短周期元素x.y.z组成的化合物y2x和zx2,y2x溶于水形成的水溶液能与zx2反应生成一种化合物y2zx3。已知三种元素原子的电子总数为25,z和y的原子序数之和比x的原子序数的2倍还多1,z原子的最外层电子数是次外层电子数的2倍。试回答:
(1)x.y.z元素的名称:x___________ y___________ z____________
(2)写出zx2的化学式__________________________________。
(3)y2x对应水化物的电子式__ ,其中存在的化学键______ (填名称)
20.(6分)A.B.C.D是四种短周期元素,它们的原子序数依次增大,其中A.C与B.D分别是同主族元素,又知B.D两元素的原子核中质子数之和是A.C两原子核中质子数之和的2倍,这四种元素的单质中常温下有2种气体,另2种为固体,且一种为金属。
(1)写出A.D的元素符号:A ,B ,C ,D ;
(2)写出B.C元素形成的原子数比1:1的化合物与A.B元素形成的原子数2:1的化合物反应的化学方程式 ;(2分)
21.(6分)已知A.B.C均为短周期元素形成的单质,且元素A.B同周期,A元素原子半径大于B元素原子半径,在一定条件下单质A和单质B.单质A和C都按物质的量2:1反应,分别生成X和Y,在产物中B.C两元素呈负价。分别取3份完全相同且质量均为1.52g由单质A和单质B组成的混和物进行下列实验:
①在第一份样品中加入过量盐酸,充分搅拌后在标准状况下放出0.896L H2残留不溶于酸的固体0.56g
②在第二份样品中加入过量浓NaOH溶液,微热充分反应后在标准状况下放出0.896L H2
残留不溶于碱的固体0.96g
③将第三份样品隔绝空气加强热生成化合物X,将X投入稀盐酸中,X溶解且放出在空气中能自燃的气体a L
根据上述题给信息和实验记录解答下列问题
(1)写出下列元素的名称:
A: ;B: ;C: ;
(2)混和物中B的质量分数是:
(3)写出实验③中有关反应的化学方程式,并计算a的值。(2分)
五.计算题(本题包括2小题 4+5分,共9分)
22. (4分)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多
少。
23.(5分)将一定体积的CO2通入含有10g NaOH的溶液中,当CO2全部被吸收后,减压蒸发,最后得到14.8g白色固体,求(1)14.8g固体成分。(2)通入CO2气体的质量。
下学期期末考试高一化学试卷(A)
1.A 2.C 3.A 4.B 5.C 6.B 7.B 8.C 9.B 10.B 11.C 12.A 13.B 14.A 15.A 16.D
17.二氧化锰(MnO2)(2)装置(C)的作用:
①干燥气体(或除去混合气体的水蒸气),
②观察气体的流速,使SO2与O2以最佳比混合
|
(3)Cu + 2H2SO4 ( 浓 ) ═ CuSO4 + SO2 ↑+ 2H20
|
2SO2+O2==== 2SO3(2分) (4)使SO3冷却成固体
17. (1)甲、丙、戊 (2)乙 加热 (3)丁 硫酸是高沸点酸,没有挥发性。
(4)下列任意两种(或其它可行方案)均可
|
| 操 作 | 根据现象做出结论 |
| A. | 滴加到氯化钠固体中 | 产生白雾的是浓硫酸 |
| B. | 加入铝片 | 常温下反应的是稀硫酸,不反应的是浓硫酸 |
| 加入品红溶液 | 褪色的浓硫酸 | |
| 加入木炭,加热 | 产生刺激性气味气体的是浓硫酸 | |
| 称量相同体积的酸 | 质量大的是浓硫酸 | |
| 在相同条件下加热 | 先沸腾的是稀硫酸 |
18.⑴HF>NH3 ⑵N3->F->Na+>Mg2+ ⑶m-9.m+19 ⑷Na2S.K2S.MgF2.MgBr2
19.(1)x 氧 y 钠 z 碳 (2) CO2 (3)Na+[ :O:H]—,离子键 极性键
20.(1)A:H,B:O,C:Na,D:S;(2)2Na2O2+2H2O=4NaOH+O2;
21. 1)A:镁 B:硅 C:氧(每空2分,共6分)
(2)![]() (3)
(3)![]()
Mg2Si;
Mg2Si+4HCl 2MgCl2+SiH4↑(每空1分,共2分)
n(SiH4)=n(Mg2Si)![]()
22. (1)
4NH3+6NO 5N2+6H2O
(2)NO : 0.8mol NH3 : 0.2mol 或NO : 0.3mol NH3 : 0.7mol
23. 解析:可能发生反应路线如图
![]()
|
|
若10g NaOH全部生成Na2CO3,Na2CO3质量为
![]() 若10g NaOH全部生成NaHCO3,NaHCO3质量为
若10g NaOH全部生成NaHCO3,NaHCO3质量为
而13.25g<14.8g<21g [极限思想,抓两端定中间]
∴14.8g固体为NaHCO3、Na2CO3混合物
设NaHCO3为xmol, Na2CO3 为ymol
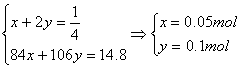 Na元素守恒:
Na元素守恒:
利用C元素守恒可知m(CO2)=n(CO2)·M(CO2)=(x+y)×44g/m=6.6g
[评析]巧用极端假设思想-抓两端定中间,确定成分物,先用不等式判断产物中成分,再进行计算,总结出定NaOH时CO2与NaOH反应减压蒸发成分是增加的趋势,若CO2为定值时,CO2与NaOH反应减压蒸发成分是递减的趋势。