物质结构 元素周期律单元测试题
一、选择题
1.一种比黄金贵百倍的818O2气体,不久前在兰州近代物理研究所制备成功。1mol818O2气体中所含中子的物质的量为( )
A.16mol B.18mol C.20mol D.24mol
2.含硒(Se)的保健品已开始进入市场。已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
3.下列元素中,最高正化合价数值最大的是( )
A.C B.S C.F D.Ne
4.下列化合物中,阳离子半径与阴离子半径比值最小的是( )
A.NaF B.NaCl C.MgI2 D.KBr
5.医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是( )
A.53153I是碘的一种同素异形体
B.53135I是一种新发现的元素
C.53135I核内的中子数与核外电子数之差为29
D.53135I位于元素周期表中第4周期ⅦA族
6.物质的量相同的Mg2+、F-、H2O三种微粒,一定含有相同的( )
A.电子数 B.质子数 C.中子数 D.质量数
7.下列化合物中,既含有极性键又含有非极性键的是( )
A.Na2O2 B.NH4Cl C.CH4 D.H2O2
8.氯化钠是日常生活中人们常用的调味品。下列性质可以证明氯化钠中一定存在离子键的是( )
A.具有较高的熔点 B.熔融状态能导电
C.水溶液能导电 D.常温下能溶于水
9.下列各组中的分子,全部是以极性键形成的非极性分子的是( )
A.H2、N2、Cl2 B.CH4、NH3、H2O
C.CO2、CS2、CCl4 D.HCl、NO、Br2
10.下列说法正确的是( )
A.难失电子的原子,得电子的能力一定强
B.易得电子的原子,失电子的能力一定弱
C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大
D.任何原子的原子核都是由质子和中子构成的
11.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A.n=m+16 B.n=m+6 C.n=m+30 D.n=m+10
12.A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为( )
A.n+8 B.n+18 C.n+32 D.n+20
13.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、e、d、c B.e、d、a、b、c
C.a、b、d、c、e D.c、d、e、a、b
14.下列说法中,不正确的是( )
A.双原子分子中的共价键,一定是非极性键
B.非极性键也可能存在于离子化合物中
C.分子间作用力,又叫范德华力,它比化学键要弱得多
D.共价化合物在液态时不能导电
15.元素周期表的第7周期称为不定全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是( )
A.该周期的元素都是放射性元素
B.该周期的元素,原子序数最大为118
C.该周期的ⅦA族元素是金属元素
D.该周期的ⅢA族的元素的氢氧化物具有两性
二、选择题
16.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是( )
A.M层 B.K层 C.L层 D.P层
17.硼有两种天然同位素510B和511B,硼元素的相对原子质量为10.80,则对硼元素中510B的质量百分含量的判断正确的是( )
A.20% B.大于20% C.大于20% D.80%
18.R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是( )
A.原子半径:R<Q B.R和Q可形成离子化合物
C.R和Q可形成非极性分子RO2 D.R和Q可形成共价化合物RO3
19.A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是( )
A.原子序数:A<B B.A和B可能在同一主族
C.A可能在第2周期ⅣA族 D.A肯定是金属元素
20.过氧化铬(CrO5)的结构为: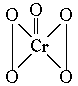 ,由此可推知在CrO5中氧元素的化合价应该是( )
,由此可推知在CrO5中氧元素的化合价应该是( )
A.全部-1价 B.4/5为-1价,1/5为-2价
C.全部-2价 D.4/5为-2价,1/5为-1价
21.下列叙述中,不正确的是( )
A.不同的原子之间只能构成共价化合物
B.单质中不一定存在非极性键
C.非金属原子之间只能构成共价化合物
D.Cl2的沸点比F2高,这与分子间作用力的大小有关
22.已知NaCl的摩尔质量为Mg·mol-1,食盐晶体的密度为ρg·cm-3,若右图中Na+与最邻近的Cl-的核间距离为acm,那么阿伏加德罗常数的值可表示为( )
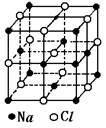
A.2Ma3ρ B.M/a3ρ C.2M/a3ρ D.M/2a3ρ
23.有物质的量相等的短周期金属元素单质A和B,在A中加入足量盐酸,在B中加入足量稀硫酸,反应完全后,生成氢气的体积分别为V1和V2,且V1≠V2,若要确定生成物中A和B的化合价,至少还需要的数据是( )
A.V1∶V2的值 B.V1和V2的值
C.A和B的物质的量 D.盐酸和稀硫酸的浓度
24.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W D.金属性:X>Y,还原性:W2->Z-
25.同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
A.它是一种共价化合物 B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应 D.它受热时,可能会分解产生有色气体
三、填空题
26.有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B![]() C+D↑
C+D↑
(2)C+C![]() A+E
A+E
(3)D+E![]() B+C
B+C
由此可知它们的化学式分别为:
A ,B ,
C ,D ,
E 。
27.A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: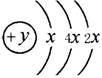 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
28.金(Au)是最为常见的贵重金属,常制作首饰。金元素的原子序数为79,它在元素周期表中位于第 周期 族。
29.X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物时,其电子式为 ,若XY2为共价化合物时,其形成过程的电子式为 。
30.若K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O,则此反应中生成的氯气,平均相对分子质量约为:(计算结果保留三位有效数字) 。
31.短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A | C | |
| B |
(1)A的氢化物分子式为 ,分子构型为 ,属于 分子;
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
四、框图推断题
32.气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中常见的气体,各物质有如下所示的转化关系:
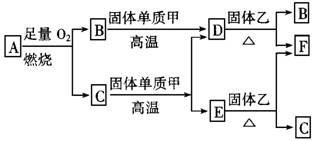
试根据上述条件回答下列问题:
(1)若气体A为混合气体,且X与Y的质量比小于3,则气体A中肯定含有 。
(2)若气体A为单一气体,且X与Y的质量比等于3,则气体A的名称叫 。
(3)C与固体甲在高温下反应的化学方程式为 。
33.A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如下关系:若A为单质有色气体,请判断:(填化学式)
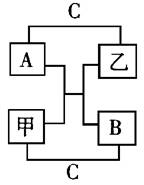
A是 ,B是 ,
C是 ,甲是 ,
乙是
五、计算题
34.某核素ZAX的氯化物XCl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数。
(2)若X的核内中子数为20,求37gXCl2中所含质子的物质的量是多少?
35.向100mL2mol/L的AlCl3溶液中加入1mol/L的NaOH溶液得到沉淀3.9g,则加入的NaOH溶液的体积应为多少mL?
36.电解普通水和重水(12H2O)的混合物,通电一段时间后,两极共生成气体18.5g,体积为33.6L(标况下)。求所生成的气体中氕和氘的原子个数比是多少?
高考真题演练
1.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材K3C60
2.下列说法中错误的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
3.关于ⅠA族单质和ⅡA族元素的下列说法中正确的是( )
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01mol/L时,氢氧化钾溶液的pH值比氢氧化钡的小
C.氧化钠的溶点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
4.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式不可能是( )
A.XYZ B.X2YZ C.X2YZ2 D.X2YZ3
5.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y所形成的化合物的电子式可表示为( )
A.XY B.XY2 C.XY3 D.X2Y3
6.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最高的原子。关于该新元素的下列叙述正确的是( )
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277∶12
7.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为( )
A.39∶61 B.61∶39 C.1∶1 D.39∶11
8.今有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同族元素,B、D两种元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶解于CS2溶剂中,则四种元素是:
(1)A B C D (2)写出两种均含有这四种元素的化合物相互反应放出气体的化学方程式:
参考答案
一、1.C 2.C 3.B 4.C 5.C 6.A 7.D 8.B 9.C 10.B 11.D 12.D 13.A 14.A 15.D
二、16.AD 17.B 18.AB 19.AC 20.B 21.AC 22.D 23.A 24.AC 25.BD
三、26.OH-,NH4+,H2O,NH3,H3O+ 27.(1)硅,SiH4 (2)N<P<Si<Mg (3)Mg(OH)2 HNO3 28.6,ⅠB
29.[∶![]()
![]() ]-Ca2+[∶
]-Ca2+[∶![]()
![]() ]-,
]-,![]() ∶+
∶+![]() C
C![]() +∶
+∶![]()
![]()
![]() ∶
∶![]() C
C![]() ∶
∶![]()
30.70.7
31.(1)NH3,三角锥形,极性 (2)S,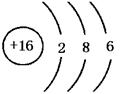 3,ⅥA (3)F2,氢氟酸。
3,ⅥA (3)F2,氢氟酸。
四、32.(1)H2 (2)甲烷 (3)H2O+C![]() CO+H2
33.F2、O2、H2、H2O、HF
CO+H2
33.F2、O2、H2、H2O、HF
五、34.(1)40 (2)18mol 35.150ml或750ml 36.3∶1
【高考真题演练】
1.C 2.D 3.B 4.A 5.A 6.B、D 7.A
8.(1)A:H B:O C:Na D:S (2)NaHSO3+NaHSO4![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O