物质结构单元测试
第I卷(60分)
一.选择题(每小题只有1个选项)
1.19世纪末,开始揭示原子内部的秘密,最早发现电子的科学家是( )
A.意大利物理学家阿伏加德罗 B.法国化学家拉瓦锡
C.英国科学家汤姆生 D.英国科学家道尔顿
2据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、…的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的( )
A.第6周期ⅣA族 B.第7周期ⅥA族
C.第7周期Ⅷ族 D.第8周期ⅥA族
3.已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2-易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
A.①②③ B.②③④ C.③④⑤ D.①③⑤
4.x原子获得3个电子或Y原子失去2个电子后形成的离子都与OH-具有相同的电子数,X与Y两单质反应得到的化合物化学式为( )
A.Y3X2 B.X3Y2 C.X2Y3 D.Y2X3
5.下列递变情况不正确的是( )
A.Na+、Mg2+、Al3+的氧化性依次增强
B.N、O、F的最高正价依次升高
C.O、S、P的原子半径依次增大
D.P3-、S2-、Cl-的还原性依次减弱
二.选择题(每小题有1~2个选项)
6.aX和bY分别是元素X和元素Y的一种同位素,已知a>b,元素X和元素Y的相对原子质量的关系是( )
A.大于 B.等于 C.小于 D.不能确定
7.下列说法不正确的是( )
A.同周期元素,原子核外电子层数一定相同
B.同主族元素,原子最外电子层上的电子数一定相等
C.同周期元素,随原子序数的递增,金属性逐渐减弱,非金属性逐渐增强
D.同主族元素,随原子核外电子层数的增多,得电子能力增强,失电子能力减弱
8.同温、同压下,等体积的两个密闭容器分别装有12C18O和14N2两种气体,关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量数不相等 B.分子数和质量数分别不相等
C.分子数、质量数分别相等 D.原子数、中子数、质子数分别相等
9.A、B、C、D、E是同一周期的五种主族元素。A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D;E是这五种元素中原子半径最小的元素。它们的原子序数由小到大的顺序是( )
A.ABCDE B.CDABE
C.BADCE D.ECDBA
10.关于化学键的叙述正确的是( )
A离子键是由阴离子和阳离子间的静电吸引而形成的
B共价化合物可能含离子键
C离子化合物只含离子键
D共价化合物不含离子键
11.有X、Y、Z三种金属,把它们放在稀硫酸中,唯有Y溶解并放出气体,将Z放入X的盐溶液中,有X金属析出,已知X、Y、Z在化合物中均显+2价,则下列结论正确的是( )
A.金属活动性Z>Y>X B.还原性:X>Y>Z
C.氧化性:X2+>Z2+>Y2+ D.氧化性:X2+>Y2+>Z2+
12.有a、b、c、d四种主族元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a阳离子的正电荷数小于b阳离子的正电荷数,c阴离子的负电荷数大于d阴离子的负电荷数,则它们的离子半径的关系是( )
A.a>b>c>d B.b>a>d>c
C.c>a>d>b D.c>d>a>b
13.X、Y、Z分别代表3种不同的短周期元素,X元素的原子最外层电子数为1,Y元素原子M层有6个电子,Z元素原子的L层电子数6,由这三种元素组成的化合物的化学式是( )
A.X3YZ4 B.X2YZ3 C.XYZ4 D.X2YZ4
14.下列电子式正确的是( )
.. .. ..
A.N:::N B.H:O:D C.H:Cl:O D.Na+[:O:H]-
.. .. ..
15.A和B是前三周期的元素,它们的离子A2-、B3+具有相同的电子层结构。下列说法中正确的是( )
A.原子序数:A>B B.原子半径:A>B
C.离子半径:A2->B3+ D.质量数:A>B
三.选择题(每小题只有1个选项)
16.若原子R的质量数为A,Rn-核外电子数为x,则W克Rn-所含中子为( )
A.(A-x+n)mol B.(A-x-n)mol
C.![]() (A-x+n)mol
D.
(A-x+n)mol
D. ![]() (A-x-n)mol
(A-x-n)mol
17.镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价 B.单质能使水分解,放出氢气
C.镭比钙的金属性弱 D.碳酸镭难溶于水
18.在两种短周期元素组成的化合物中,若它们的原子个数之比为1∶3,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a=b+4 ②a+b=8 ③a+b=30 ④a=b+8
A.只有②③ B.只有②③④
C.只有③④ D.①②③④
19.两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是( )
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
20.据权威刊物报导,1996年科学家在宇宙中发现H3分子的存在,据此下列有关说法中具有科学性的推测是 ( )
A.H3与H2互为同位素
B.H3分子是不可能存在的,因为H3分子违背了传统的共价键理论
C.因为氢有三种同位素,所以宇宙中应还有另一种氢单质H4
D.H3分子的发现,证明传统的共价键理论尚有缺陷,有待继续发展
姓名 班级 分数 .
第Ⅰ卷答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷 (共60分)
四. 填空题(47分)
21. (4分)某阴离子Rn- ,该离子核外共有X个电子,R的质量数为A,则R有 个中子。某阳离子Mn+的核外共有Z个电子,核内有N个中子,则M的质量数为: .
22. (6分)等质量的H2O和D2O,所含氧原子的个数比为 . 它们与足量金属钠完全反应放出气体的体积比(同温同压)为 ,质量比为 .
23.(7分)A、B两种离子具有相同的电子层,A、B两元素的单质都能与水剧烈反应,在反应中A单质为氧化剂,B单质为还原剂。则:
(1)A元素位于______________周期______________族。新发现A的一种含氧酸的化学式为HAO,其中A的化合价为______________。
(2)A单质与水反应的化学方程式为______________。
(3)B单质与水反应的离子方程式为______________。
24.(16分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,0.1molE单质与足量酸作用,在标准状况下能产生3.36LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
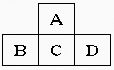
(1)五种元素的名称:A__________,B______________,C____________,D_____________,E______________。
(2)画出C原子、A离子的结构示意图:______________。
(3)B单质在D单质中燃烧,反应现象是______________,生成物的化学式为__________
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是___________________________,有关反应的离子方程式为________________。
25.(共6分) Li3N是离子化合物,它与水作用可生成NH3,试回答
(1) 写出Li3N的电子式________
(2)写出Li3N与水反应的化学方程式________
(3)微粒半径关系,Li+________N3-,Li________N(填>、<、=)
26.(8分)A、B、C、D、E为原子序数逐渐增大的主族元素,已知A、B、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A______________,E______________,D______________。
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:_____________
A、E两元素最高价氧化物的水化物相互反应的化学方程式:
______________________。
(3)比较D、E最高价氧化物对应水化物的酸性: 。
五.计算题(13分)
27.A元素最高价离子0.5mol被还原成中性原子时得到6.02×1023 个电子,当A的单质与盐酸充分反应放出0.02g氢气,消耗A单质0.4g,B元素的原子核外电子层数与A原子相同,B元素形成的单质为深红棕色的液体。
(1). A、B两元素为A ,B .
(2). 用电子式表示A、B形成化合物的过程 .
(3). 这种化合物所含的化学键为 .
28.某元素的同位素原子ZAX,其氯化物XCl21.11g配成溶液后,需用1mol/L的AgNO3溶液20mL,才能把氯离子完全沉淀下来。已知同位素中有20个中子。
(1)计算X的质量数是多少。
(2)指出X元素在周期表中的位置(周期、族)。
(3)把X的单质放入水中,有何反应现象?滴入的酚酞呈现什么颜色?写出有关的化学方程式。
答案
选择题
1 .C 2 .B 3 .B 4 .A 5 .B 6 .D 7 .D 8 .A 9 .C 10.D
11.C 12.D 13.BD 14.BD 15.C 16.C 17.C 18.D 19.A 20.D
21.A-X+n Z+n+N
22.10:9 10:9 5:9
23.(1)二 VIIA -1
![]() (2)2F2+2H2O=4HF+O2
(2)2F2+2H2O=4HF+O2
(3)2Na+2H2O=2Na++2OH-+H2
![]()
![]() 24.(1)氧 磷 硫 氯 铝
24.(1)氧 磷 硫 氯 铝
(2)S +16 2 8 6 O2- +8 2 8
(3)白色烟雾 PCl3 PCl5
(4)Al2O3 两性氧化物
(5)先有白色沉淀产生然后又消失 Al3++4OH--=AlO2-+2H2O
25.(1) Li+
。。
Li+[:N:]3-Li+
![]() . .
. .
(2) Li3N+3H2O=3LiOH+NH3
(3) < >
26.(1)A Na E Cl D P
(2)Al(OH)3+NaOH=NaAlO2+2H2O
NaOH+HClO4=NaClO4+H2O
(4) H3PO4<HClO4
27.(1)A Ca B Br
![]()
![]() (2) 。。 ..
。。 ..
。。 . .
. . 。。
(2) 。。 ..
。。 ..
。。 . .
. . 。。
![]() :Br. + . Ca. + . Br:
[:Br:]-Ca2+[:Br:]-
:Br. + . Ca. + . Br:
[:Br:]-Ca2+[:Br:]-
. . . . . . . .
(3)离子键
28.(1)40
(2)四周期 IIA族
![]() (3)剧烈反应,产生气体滴入酚酞后显红色Ca+2H2O=Ca(OH)2+H2
(3)剧烈反应,产生气体滴入酚酞后显红色Ca+2H2O=Ca(OH)2+H2