《碱金属》单元检测
本卷可能用到的相对原子质量:
H 1 Li 7 C 12 S 32 Na 23 O 16 Cl 35.5 K 39 Rb 85 Cs 133
一、选择题(每小题只有1个正确答案)
1.钠着火时,采用哪种来灭火方式最好 ( )
A 水 B 煤油 C 泡沫灭火器 D 砂子
2.下列关系正确的是 ( )
A 还原性 Na>K B 离子半径 Na+>K+
C 热稳定性 Na2CO3>NaHCO3 D 熔点 Na<K
3.少量NaOH最好贮存在 ( )
A、敞口塑料瓶中 B、玻璃塞的棕色瓶中
C、橡胶塞的广口瓶中 D、铁制容器中
4.下列叙述中不正确的是 ( )
A 钠在反应TiCl4+4Na=Ti+4NaCl中作还原剂B NaOH应密封保存,以防分解变质
C 金属锂不能保存在煤油中 D 盛放KOH溶液的试剂瓶不能用玻璃塞
5.将6g钠和3.2g硫粉迅速混合,放在石棉网上加热,反应后所得固体物质的成分是( )
A. Na2O和S B. Na2O和Na2O2 C. Na2O和Na2S D. Na2O2和Na2S
6.在实验室里做钠跟水反应的实验时,用到的仪器是 ( )
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵 g.烧杯 h.坩埚
i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
A. abdi B. cefk C. fghl D. bcegj
7.从理论上讲,Li是很活泼的金属,与水反应应当很剧烈。但事实上反应却是开始较快,一会儿就迅速缓慢起来。其原因主要是 ( )
A. Li的密度很小,浮在水面上 B. 生成物LiOH溶解度较小,附着在Li表面
C. 反应开始放热而使速率变慢 D. 反应产物对此反应有催化作用
8.能正确表示下列反应离子方程式的是 ( )
A. 钠跟水反应:2Na+2H2O==2Na++2OH-+H2↑
B. 钠跟盐酸反应:2Na+2H+==2Na++H2↑
C. 钠跟FeCl3溶液反应:3Na+Fe3+==Fe+3Na+
D. 三氧化硫与氢氧化钠溶液反应:SO3+2NaOH==2Na++SO42-+H2O
9.在一定温度下,向饱和烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是 ( )
A. 溶液中Na+浓度增大,有O2放出 B. 溶液pH值不变,有H2放出
C. 溶液中Na+数目减少,有O2放出 D. 溶液pH值增大,有O2放出
10.为了使鱼苗顺利运输,必须满足三个条件:①需要保持适量的氧气,②使鱼苗呼出的CO2及时排出,③防止细菌大量繁殖。已知下述四种物质加入水中都可以起到供氧灭菌的作用,过氧化钙极微溶于水。在长距离运输鱼苗的水中,最好加入 ( )
A. Na2O2 B. 氯水 C. CaO2 D. H2O2
11.分别含有下列四种杂质的纯碱样品,含杂质的质量分数相同,取等量的四种样品与浓度相同的盐酸反应,所消耗的盐酸体积由多到少的顺序是(杂质:①NaOH ②Ca(OH)2
③NaHCO3 ④CaCO3) ( )
A. ①>②>④>③ B. ③>④>①>② C. ②>①>④>③ D. ④>③>②>①
12.想一想,NaOH(固)、P2O5(固)、CaCl2(无水)为什么可归为一类。据此,从A~D中选出能与这三种物质归为一类的是 ( )
A. 浓H2SO4 B. NaCl C. 碱石灰 D. CaO
13.某种混合气体可能含有N2、HCl和CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积减小;最后通过灼热的铜网,经充分反应气体体积又减小,但气体还有剩余。以下对混合气体的组成判断正确的是
( )
A. 一定没有N2,CO和HCl中至少有一种B. 一定有N2、HCl和CO
C. 一定有N2,CO和HCl至少有一种 D. 一定有N2和HCl,没有CO
14.下列对进行焰色反应的实验操作注意事项的说明,正确的是 ( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰无色时,再蘸被检验物质
③每次实验后都要将铂丝蘸浓盐酸后灼烧至火焰无色为止
④实验时最好选择本身颜色较强的火焰
⑤没有铂丝可用无锈铁丝代替
A. 仅③不正确 B. 仅④不正确 C. ④、⑤不正确 D. 全部正确
15.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律。如:Na2O2+SO2==Na2SO4,2Na2O2+2SO3==2Na2SO4+O2,据此,你认为下列反应方程式中正确的是 ( )
①. 2Na2O2+2Mn2O7==4NaMnO4+O2 ② 2Na2O2+2NO2==2NaNO2+O2
③. 2N2O3+2Na2O2==4NaNO2+O2 ④. 2N2O5+2Na2O2==4NaNO3+O2
A 只有① B ②③ C ①④ D ②③④
二、填空题
16.碱金属的原子半径 (填“大于”、“小于”)相应的离子半径。在碱金属(Li、Na、K、Rb、Cs)和卤素(F、Cl、Br、I)间相互形成的化合物中,阳离子半径与此同时阴离子半径之比最小的化合物化学式为 ,之比最大的化合物化学式为 。
17.某浅黄色粉末可能由Na2O2、S、Ag2CO3、中的一种或几种组成,用它进行如下
实验:①取少量粉末于试管中加蒸馏水,有部分溶解现象并逸出无色气体,仍有浅黄色粉末未溶解;②将试管加热,发现未溶的黄色粉未溶解,成为无色透明溶液,但无气体放出;③将②的液体用稀H2SO4酸化,发现又有浅黄色浑浊出现;④将①中溶液进行焰色反应,火焰呈黄色。
试回答:(1)某浅黄色粉末的组成是 _______________
(2)步骤①中的反应的化学方程式是 _______________________
(3)写出步骤②的化学方程式 ________________ _
18.(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)
①Na2O2
; ②Na2O 。![]()
(2)指出氧在下列物质中的化合价
O3: Na2O2 Na2O:
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式: 。
(4)人体内O2-对健康有害,使人过早衰老,但在催化剂![]() 存在下可发生如下反应,请完成该反应的离子方程式:£
存在下可发生如下反应,请完成该反应的离子方程式:£![]() +£
+£![]() =£
=£![]() +£
+£![]() +£
+£
三、实验题
19.实验室里,欲从事草木灰中除去不溶于水的固体杂质来提取固体碳酸钾。
(1)该实验操作的主要步骤排列顺序为(用A、B、…表示) 。
A、蒸发 B、过滤 C、溶解 D、冷却
(2)怎样用实验证明提取的固体主要成分是K2CO3 。答: 。
(3)检验在粗制碳酸钾溶液中含少量 SO42-的方法是 。
(4)检验在粗制碳酸钾溶液中含少量Cl-的方法是 。
(5)要制得纯度更高的碳酸钾晶体的方法是 。
20.Na2CO3是一种很重要的化学物质,某中学某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:(ⅰ)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ⅱ)小心煮沸溶液1~2分钟;(ⅲ)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)在(ⅰ)中,刚通入CO2时发生的反应是 ;而后又发生反应 ;将以上两个反应分别改写成离子反应是 、 。
(ⅱ)中煮沸溶液的目的是 。
(ⅲ)中混合另一半NaOH溶液后发生的反应是 ,改写为离子方程式是 。
评价该同学能否制得较纯净的Na2CO3? 。
(2)按该同学的设计,第(ⅰ)步实验装置如下:
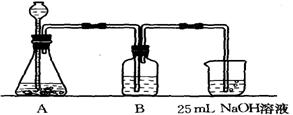
①装置A使用的试剂是 (固体)和 溶液;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ,不选择其它三种试剂的原因是(简要文字说明) ;写出B中可能发生的离子方程式 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
③有人认为实验步骤(ⅱ)、(iii)的顺序对调,即先混合,再煮沸,更合理,你认为对吗? 。为什么? 。
四.计算题
21.呼吸面具中的Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2也可起到同样的作用。实验测得相同体积的CO2气体通过足量的Na2O2和KO2,充分反应后,后者生成O2的体积是前者的3倍。
(1)若将30mlCO2通过盛有足量KO2的装置,充分反应后,逸出气体的体积变为多少毫升?
(2)若将一定体积的CO2通过盛有足量KO2和Na2O2均匀混全物的装置,充分反应后,逸出气体的体积变为原CO2体积的1.3倍。求混合物中KO2 和Na2O2的质量比。
参考答案:1.D 2.C 3.C 4.B 5.D 6.D 7.B 8.A 9.C 10.C 11.C 12.D 13.C 14.B 15.C 16.大于;LiI;CsF
17.(1)Na2O2、S (2)![]()
(3)![]()
18(1)2Na+O2=Na2O2(在纯氧气中或在空气中燃烧)
2Na+O2=Na2O(钠暴露在空气中)
(2)0 -1 -2 (3)4 KO2+2 CO2=2 K2CO3+3 O2↑
(4)![]()
19.(1)C、B、A、D (2)取少量固体加入盐酸,反应产生无色地味气体,并使澄清石灰水变浑浊,证明有CO32-;取少量固体进行焰色反应,透过蓝色钴玻璃看到紫色,证明有K+。(3)先加稀HNO3,至气泡放尽后再加BaCl2溶液,有白色沉淀。(4)先加稀HNO3,至气泡放尽后再加AgNO3溶液,有白色沉淀。(5)重结晶
20(1)NaOH+CO2=Na2CO3+H2O Na2CO3+CO2+H2O=2NaHCO3 OH-+CO2=CO32-+H2O CO32-+CO2+H2O=2HCO3- 生成NaHCO3后过量溶解的CO2气体在煮沸时除去 NaOH+NaHCO3=Na2CO3+H2O OH-+HCO3-=CO32-+H2O 能
(2)①石灰石 盐酸 ②饱和NaHCO3 除去HCl NaOH、Na2CO3能与CO2反应,CO2在水中有一定溶解能力 HCO3-+H+=H2O+CO2↑ NaCl、NaOH
③不合理;若不先驱出溶液中溶解的CO2气体,实验(iii)加入的NaOH将有一部分消耗于与CO2的反应,使NaHCO3不能完全转化为Na2CO3。
21.(1)45mL (2)284:39