《物质的量》单元检测题
班 姓名 学号 计分
说明: 1、本卷满分100分 时量90分钟
2、本卷可能用到的相对原子质量:H 1 Li 7 C 12 S 32 Na 23 O 16 Cl 35.5 K 39 Rb 85 Cs 133
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有1个正确答案, 每小题3分,共48分)
1、影响一定量气体占有气体大小的主要因素是 ( )
A、气体分子的微粒数 B、微粒本身的大小
C、微粒的质量 D、微粒间的平均距离
2、下列叙述正确的是 ( )
A、1molO2的质量为32g/mol B、1mol物质的质量等于该物质的式量
C、SO42-的摩尔质量为96g/mol D、CO2的摩尔质量为44g
3、设NA代表阿佛加德罗常数,下列说法不正确的是: ( )
A、醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等
B、NA个氧分子和NA个氢分子的质量比等于16:1
C、28克氮气所含的原子数目为NA
D、在标准状况下,0.5NA个氯气分子所占体积是11.2升
4、配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是 ( )
A、倾出标线以上的液体 B、吸出标线以上的溶液
C、影响不大,不再处理 D、重新配制
5、下列实验操作所用仪器合理的是 ( )
A、用25mL碱式滴定管量取14.80mLNaOH溶液 B、用100mL量筒量取5.2mL盐酸
C、用托盘天平称取25.20gNaCl D、用100mL容量瓶配制50mL0.10mol/L溶液
6、将①氢气;②氧气;③甲烷三种气体分别盛放在三个容器中,并保持三个容器内气体的温度和密度均相等,这三种气体对容器所施加压强的大小关系是 ( )
A、①>②=③ B、①<②<③ C、①>③>② D、①<③<②
7、19世纪,化学家对氧化锆的化学式有争议。后经化学实验测定,锆(Zr)的相对原子质量约为91,其氯化物蒸气的密度是同温同压下H2密度的116~117倍。试推断与氯化物价态相同的氧化锆的化学式为 ( )
A.、ZrO B、Zr2O C、Zr2O3 D、ZrO2
8、有五瓶溶液分别是:①10mL0.60mol/LNaOH水溶液;②20mL0.50mol/LH2SO4水溶液;③30mL0.40mol/LHCl水溶液;④40mL0.30mol/LCH3COOH水溶液;⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A、①>②>③>④>⑤ B、②>①>③>④>⑤ C、②>③>④>①>⑤ D、⑤>④>③>②>①
9、下列数量的各物质所含原子数(包括离子)由大到小顺序排列的是①0.5mol NH3②22.4L氦气(标准状况)③4℃时9mL水 ④0.2mol Na3PO4 ( )
A、①④③② B、④③②① C、②③④① D、①④②③
10、相对分子质量为M的某物质在室温下的溶解度为Sg/100g水,此时测得饱和溶液的密度为dg/cm3,则该饱和溶液的物质的量浓度是 ( )
A、![]() mol/L B、
mol/L B、![]() mol/L C、
mol/L C、![]() mol/L D、
mol/L D、![]() mol/L
mol/L
11、将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为( )
A、![]() mol/L B、
mol/L B、![]() mol/L C、
mol/L C、![]() mol/L D、
mol/L D、![]() mol/L
mol/L
12、300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为
( )
A、1:4 B、1:5 C、2:1 D、2:3
13、实验测得乙烯(C2H4)与氧气混和气体的密度是氢气14.5倍,可知其中乙烯的质量百分比为( )
A、25.0% B、27.6% C、72.4% D、75.0%
14、两份体积相同的某植物营养液,其配方如下:
|
量 编 号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| ① | 0.3mol | 0.2mol | 0.1mol | — |
| ② | 0.1mol | 0.3mol | — | 0.1mol |
两份营养液的成分 ( )
A. n(K+)相同 B. n(Cl-)相同 C. 完全相同 D. 完全不同
15、在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有5摩尔电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是 ( )
A、1∶5 B、5∶1 C、6∶1 D、1∶6
16、密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
A.等于13.5% B.大于12.5%
C.小于12.5% D.无法确定
二、填空题(共21分)
17(6分)根据反应:KClO3+6HCl==KCl+3Cl2↑+3H2O,若有0.5mol电子转移,则⑴有______molCl2生成。⑵有___________个HCl被氧化。⑶有__________个+5价Cl被还原。
18(4分)科学实验测定,每亩森林每月可吸收4kgSO2气体,如果每月按30天计算,那么每亩森林每天可吸收SO2的分子数是________________,每年可吸收SO2的物质的量是________mol。
19(3分)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
20(8分)同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。
三、实验题(20分)
21(6分)配制0.1mol/L盐酸溶液500mL,请按操作顺序[⑴、⑵、⑶……]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500mL),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500mL的容量瓶中。
( )用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数) mL注入烧杯中。
( )用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
( )往容量瓶中小心加蒸馏水至液面接近刻度________cm处,改用________加蒸馏水,使溶液__________恰好与刻度线相切。
22、(14分)为了测定某气体样品C4H10(并含有少量C3H8,均不溶于水)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1;
②往锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直至前后两次称量结果基本相同,得到质量m2;
③往锥形瓶内加满水,塞好胶塞,称量,得到质量m3。
已知实验时的温度为T(K),压强为p(kPa),水的密度为ρ水(g/L),空气的相对平均分子质量为29.0,密度为ρ空气(g/L)。回答下列问题:
⑴本实验的原理是(具体说明)________________________________________________。
⑵步骤②中为什么要重复操作,直至前后两次称量结果基本相同?
答:______________________________________________________________________。
⑶具体说明本实验中怎样做到每次测量都是在相同体积下进行的?
答:______________________________________________________________________。
⑷本实验中收集气体样品的操作,可选用的方法是(填下图中标号)___________。
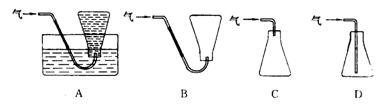
⑸锥形瓶中空气的质量(m空气)是___________________________(列出算式)。
⑹锥形瓶中样品的质量(m样品)是___________________________(列出算式)。
⑺由实验测得该气体样品的平均相对分子质量是________________________(列出算式)。
三、计算题(11分)
24(5分)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积为多少?
25(6分)19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数。在250℃时,四种化合物都是气态。将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直至每个烧瓶内的压强达到1.013×105Pa。称每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量。用氮气重复这一过程,得到如下数据表。
| 气体 | 气体的质量/g | 气体中X元素的质量分数/% |
| N2 | 0.652 | — |
| A | 0.849 | 97.4 |
| B | 2.398 | 68.9 |
| C | 4.851 | 85.1 |
| D | 3.583 | 92.2 |
请通过计算后确定元素X可能的摩尔质量(要求写出推算过程)。
参考答案:
1、D 2、C 3、C 4、D 5、A 6、C 7、D 8、D 9、A 10、B 11、B
12、A 13、C 14、A 15、B 16、C
17、⑴0.3 ⑵3.01×1023 ⑶6.02×1023 (每线2分)
18、1.25×1024 0.75×103 (每线2分)
19、 34.2
20、1:2 2:1 3:1 2:3 (每线2分)
21、⑵⑶⑴⑷⑸ (2分) 42mL 1~2 胶头滴管滴加 凹液面 (每线1分)
23、⑴同温同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比
⑵为了保证瓶内的空气已完全被排出,并充满样品气 ⑶第一次称量前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上做一记号,以后每次测量,胶塞塞入瓶口的位置都以此为准 ⑷D
⑸![]() ⑹
⑹![]() ⑺
⑺![]() (每小题1分)
(每小题1分)
24、5/6
25、35.5g/mol
 含 成分
含 成分