高一下学期二月月考化学试题
京山一中高一化学组
第Ⅰ卷(共60分)
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.我国城市环境中的大气污染物主要是( )
A .CO、Cl2、N2、酸雨 B.HCl、O2、N2、 粉尘
C .SO2、NO2、CO、粉尘 D .NH3、CO2、NO、雾
2. 在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是( ) A 3%H2O2溶液 B 1 mol/L NaOH溶液 C 1 mol/LKClO3溶液 D 1 mol/L盐酸
3.下列变化需要加入还原剂方能发生的是 ( )
A. ![]() →SO2 B. S2- → S C. SO2
→ S D. SO3
→H2SO4
→SO2 B. S2- → S C. SO2
→ S D. SO3
→H2SO4
4.下列反应中,调节反应物的用量或浓度不会改变反应产物的是( ) AH2S在氧气中燃烧 B铁在硫蒸气中燃烧
C二氧化硫通入石灰水中 D 硫酸中加入锌粉
5. 科学家预测116号元素具有相当稳定的同位素,关于它的性质预测错误的是( ) A它的原子最外层有6个电子 B它是主族元素的金属
C它具有-2、+4、+6价 D它是一种金属性较强的元素
6.下列反应中硫化氢不做还原剂的是 ( )
A. 2H2S+3O2=2H2O+2SO2↑ B. H2S+2FeCl3=2FeCl2+S↓+2HCl
C. H2S+I2=2HI+S↓ D. 4Ag+2H2S+O2=2Ag2S↓+2H2O
7. 在一定条件下,某化合物X受热完全分解,![]() 。测得反应后生成的混合气体对H2的相树密度为11.43。在相同条件下,X的相对分子质量是 ( )
A.11.43 B.22.85
C.80.01 D.160.02
。测得反应后生成的混合气体对H2的相树密度为11.43。在相同条件下,X的相对分子质量是 ( )
A.11.43 B.22.85
C.80.01 D.160.02
8.下列说法正确的是( )
A酸性氧化物一定是非金属氧化物 B碱性氧化物一定是金属氧化物 C非金属氧化物一定是酸性氧化物 D酸性氧化物不一定是某酸的酸酐
9.用下列方法制取氧气:①KClO3与MnO2混合加热 ②Na2O2跟水反应 ③H2O2滴入MnO2粉末中 ④KMnO4受热分解⑤电解H2O。要制得相同质量的氧气,上述各反应中依编号顺序电子转移数目之比( )
A. 3∶2∶2∶4∶2 B. 1∶1∶1∶1∶1
C. 2∶1∶1∶2∶2 D. 1∶2∶1∶2∶2
10.下列各组物质不能发生反应的是 ( )
A. Fe(NO3)2溶液与稀盐酸 B. H2O2与氢溴酸
C. SO2通入氯化钙溶液中 D. FeS与稀盐酸
二、选择题(每题有1—2个答案,本题共10小题,每题3分,共30分)
11.下列物质可盛在钢瓶中的是( )
A液氯 B浓硫酸 C 浓盐酸 D蓝矾溶液
12.SO2和Cl2都具有漂白作用,若将等物质的量的两种气体混合, 再通入品红与BaCl2的混合溶液中,则可观察到 ( )
A. 溶液立即褪色且无沉淀 B.溶液慢慢褪色,无沉淀
C. 先褪色后恢复原色 ,出现沉淀 D. 溶液不褪色,出现沉淀
13. 在200℃时,11.6g CO2和H2O(气)的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均相对分子质量为 ( )
A.5.6 B.23.2 C.21.6 D.46.4
14.在25℃的条件下,将50 mL密度为1.84g/mL、H2SO4质量分数为98%的浓硫酸溶于一定量的水中,配成9.2 mol/L的H2SO4溶液,则需水的体积为( )
A等于50mL B 大于50mL C小于50mL D无法确定
15.向50 mL18 mol/L H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量为( )
A小于0.45 mol B等于0.45 mol
C 在0.45和0.90mol 之间 D 大于0.90mol
16.硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1![]() 溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则
溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则![]() 将转化成
( )
将转化成
( )
A.S2- B.S C.![]() D.
D.![]()
17. 下列各组中互为同位素的是( ),互为同素异形体的是( ) A O2与 O3 B H2O2与 H2O C H与D
D O与 O2- E 35Cl2与37Cl2
18. 下列各组物质的性质及粒子变化正确的是( )
A酸性:HClO4 >H2SO4>H3PO4>H2CO3 B稳定性:H2S>HCl>HBr>HI
C粒子半径:Br—>K+>S2->S D还原性:Na>S2->Br—>Cl—
19.X元素与Y元素可形成电子层结构相同的阴离子,X的氢化物水溶液呈弱酸性, 向这种水溶液中通入X元素的某种氧化物或Y的单质,则有X游离出来,则X和Y是( )
A. O和F B. S和Cl C. F和S D. S和Br
20. 在硝酸钡溶液中通入SO2,溶液仍澄清;另取硝酸钡溶液分盛两试管, 一支加盐酸,另一支加烧碱溶液,然后再通入SO2,结果两试管都有白色沉淀。 由此得出下列结论合理的是 ( )
A. 硝酸钡具有两性 B. 两支试管内白色沉淀均是亚硫酸钡
C. SO2有还原性和酸性氧化物的通性 D. 降低pH值能使SO2水溶液中![]() 浓度增大
浓度增大
班级 姓名 学号 分数
第Ⅰ卷答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(共50分)
三、填空题(本题包括5小题,共22分)
21. (2分)某元素原子的最外层电子数是次外层的电子数的n倍(n为大于1的自然数),则该原子核内的质子数为 ___________
22. (2分)银饰物用久后,表面会变成黑色,原因是在硫化氢存在的条件下, 银被氧化成硫化银。有关反应的离子方程式是___________________________________________。
23.(6分)选用合适的试剂除杂括号内的为杂质
CO2(SO2) ___________________ SO2(HCl )___________________
H2S(HCl)___________________ Cl2(HCl)___________________
24. (6分)298K时,向V L真空容器中通入n mol SO2和m mol H2S。
(1) 若n = 2,则当m = _____时,反应后容器内气体的密度最小;
(2) 若2n > m,则反应后氧化产物与还原产物的质量差为_______ g;
(3) 若5n = m,且反应后氧化产物与还原产物的质量和为48 g,则n+m =________。
25. (6分)三位学生设计了下述三个方案,并都认为,
如果观察到的现象和自己设计的方案一致,即可确证试液中有![]() 。
。
方案甲:试液
![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
方案乙:试液
![]() 无沉淀
无沉淀 ![]() 白色沉淀
白色沉淀
方案丙:试液
![]() 无沉淀
无沉淀 ![]() 白色沉淀
白色沉淀
试评价上述各种方案是否严密,并分别说明现由。
答:______________________________________________________________________;
_________________________________________________________________________;
_________________________________________________________________________。
四、实验推断题(共18分)
26.(9分)翰林汇A、B、C、D、E五种微粒,它们都含有10个电子的离子或分子,其中A为5核离子。它们还有如下所示的转化关系:
A +B=△=C+D
E+B==2D
试写出:
(1)电子式:A ,B 。
(2)化学式: C ,D ,E 。
(3)A+D反应的离子方程式为: 。
27. (9分)为验证木炭与浓硫酸反应生成的气体M含有CO2和SO2,可按下图进行实验。各装置中可供选择的试剂是:①澄清石灰水,②品红溶液,③酸性高锰酸钾溶液。判断各装置所盛试剂后,请回答:
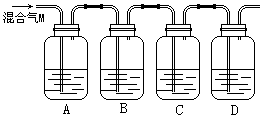
(1)A中所盛放的试剂是______(填写试剂序号),现象是 ,说明了
。
(2)B中的实验现象______,B装置的作用是 。
(3)C中所盛试剂的作用______,C装置的作用是 。
(4)D中所盛试剂应为 ,作用是 。
五、计算题(10分)
28.使一定质量的锌与100 mL18.5 mol/L浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液c(H+)=0.1mol/L。求气体A中各组分的体积比。
答 案
一、选择题(本题共10小题,每小题3分,共30分;每小题只有一个选项符合题意)
二、选择题(每题有1—2个答案,本题共10小题,每题3分,共30分;多选、21.错选无分,少选1分)
第Ⅰ卷答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | C | B | C | D | C | B | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AB | D | B | B | A | D | C、A | AD | B | C |
三、填空题(共22分)
21(2分).2n+2
22(2分).4Ag +2H2S +O2==2 Ag2S ↓+2 H2O
23(共6分,每小题1.5分).NaHCO3溶液 NaHSO3溶液
NaHS溶液 饱和NaCl溶液
24 (6分) . (1)4 (2)16m (3)3
25 (共6分). (2分)甲,不严密,因为不能排除仅含Ag+而不含SO42-的溶液的可能;
(2分)乙,严密,因为只有含SO42-的溶液才会出现此方案的现象;
(2分)丙,不严密,因为不能排除含SO32-而不含SO42-的溶液的可能。
四、实验推断题(共18分)
26 (共9分) . (4分) (1) A NH3 BOH-
(3分) (2)C NH3 D H2O E H3O+
(2分) (3) NH4++ H2O== NH3· H2O+ H+
27 (共9分,每空1分) . (1) ② 品红褪色 气体中含SO2
(2) ③ 除去SO2气体
(3) ① 检验CO2气体的存在
(4)碱液(如NaOH溶液等) 吸收多余的尾气
五、计算题(10分)
28.n(SO2)=0.3mol; n(H2)=1.2mol
V(SO2):V(H2)=1:4