高一下学期化学练习一
式量:Na 23 C 12 O 16 H 1 S 32 Cl 35.5 Mg 24 Cu 64 N 14
1、潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是因为它们均含有A、氯气 B、次氯酸 C、次氯酸根 D、氯化氢
2、IBr属于卤素互化物,它的化学性质活泼,其性质与卤素单质相似。它与水反应的化学方程式为:IBr + H2O = HBr + HIO 则下列关于IBr的叙述不正确的是A、固态的IBr是共价化合物
B、在许多反应中,IBr是强氧化剂 C、在IBr与H2O反应中,IBr既是氧化剂,又是还原剂
D、IBr与NaOH溶液反应,生成NaBr、NaIO和H2O
3、1999年新发现的114号元素的同位素,其中子数为184,该同位素原子的质量数为
A.70 B.114 C.228 D.298
4、只含有一种元素的物质A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物
C.一定是纯净物 D.一定是一种单质
5、在周期表中,第三、四、五、六周期元素的数目分别是A.8、18、32、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
6、下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl5
7、下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是A、食盐 B、漂白粉 C、氯水 D、上述选项都不对
8、氟是最活泼的非金属,能体现这个结论的是A、氢氟酸是弱酸 B、氢氟酸有剧毒
C、NaF是农药 D、氟有XeF2、KrF2等化合物
9、有一种碘和氧的化合物可以称为碘酸碘,其中碘酸根离子中碘呈+5价,则这种化合物的化学式为A、I2O4 B、I3O5 C、I4O7 D、I4O9
10、氰(CN)2、氧氰(OCN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe + 3(SCN)2 = 2Fe(SCN)3 Ag+ + CN- = AgCN¯ 拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱。下列反应式不正确的是A、2CN- + Cl2 = 2Cl- + (CN)2
|
D、MnO2 + 4HSCN= (SCN)2 + Mn(SCN)2 + 2H2O
11、砹(At)是原子序数最大的卤素元素,推测砹或砹的化合物最不可能具有的性质是
A、HAt很稳定 B、At易溶于某些有机溶剂C、AgAt不溶于水 D、砹是有色固体
12、在甲、乙、丙、丁四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2和NaOH,然后加入100mL水,搅拌,使固体完全溶于水,则甲、乙、丙、丁溶液溶质的质量分数大小顺序是
A、甲<乙<丙<丁B、丁<甲<乙=丙 C、甲=丁<乙=丙 D、丁<甲<乙<丙
13、在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是 A、0.5mol Na2CO3和1mol NaOH B、1mol Na2CO3和0.6mol NaOH
C、0.8mol Na2CO3和1mol NaOH D、只有1mol Na2CO3
14、(1)Na2O (2)NaOH (3)Na2O2 (4)Na2SO3 1mol上述固体物质,长期放置在空气中,最后质量增加的是(不考虑潮解因素)A(1)=(2)>(3)>(4) B(1)>(3)>(4)>(2) C(2)>(1)=(3)>(4) D(4)>(2)>(3)>(1)
15、在元素周期表里,金属元素的总数比非金属元素的总数A. 多 B.少 C.相等D.不能确定
16、不同元素的原子或离子,一定具有不同的A.质量数 B.质子数 C.中子数 D.电子数
17、下列各组物质的性质及粒子变化正确的是A.酸性:HClO4>H2SO4>H3PO4>H2CO3
B.还原性:Na> S2->Br->Cl- C.稳定性:H2S>HCl>HBr>HI D.粒子半径:Br-> K+> S2-> S
18、有六种微粒分别是![]() X、
X、![]() Z、
Z、![]() Q+、
Q+、![]() R2+
、
R2+
、![]() M,它们属于几种元素A2 B3 C4 D5
M,它们属于几种元素A2 B3 C4 D5
19、已知反应2X-+Z2=2Z-+X2 、2W-+X2=2X-+W2 能从左向右进行,则反应:W2+2Z-=Z2+2W- 进行的方向是A. 从左向右 B. 从右向左 C. 互不反应 D. 无法判断
20、下列分子结构中各原子的最外层电子都满足8电子稳定结构的是
A. SF6 B. XeF2 C. CS2 D. CH4
21、下列含有10电子分子组成的物质:①34g NH3 ②0.800mol HF ③标准状况下体积为11.2L的CH4 ④4℃时18.0 mL的水。含有的质子数由少到多的正确顺序是A. ②<④<①<③
B. ①<④<②<③ C. ③<①<④<② D. ③<②<④<①
22、下列各组离子:①I- ClO- NO3- H+ ②K+ Na+ HCO3- OH- ③SO32- SO42- Cl- OH-
④Fe3+ Cu2+ SO42- Cl- ⑤H+ Na+ F- Cl- ⑥Ag+ NO3- Br- Rb+
在水溶液中能大量共存的是A. ①⑥ B.②⑤ C. ③④ D. ①④
23、我国新报道的高温超导体中,铊(Tl)是组成成分之一。已知铊与铝同主族,关于铊的性质的判断可能错误的是A. 是银白色的金属 B. Tl2O3 与Al2O3一样,可溶于NaOH 溶液
C. 能形成三价化合物 D. 与稀硫酸反应生成硫酸盐
24、下列关于卤素的叙述中正确的是① 实验室中保存氢氟酸用带塑料盖的玻璃瓶
② 溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯
③ 溴化银具有感光性,碘化银不具感光性
④ 检验Cl2气体中是否混有HCl可将气体通入硝酸银溶液
⑤
氯气实验室制法的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
⑥ 氯气跟水反应时,水既不是氧化剂也不是还原剂
A. ①②⑤ B. ②④⑥ C. ②⑤⑥ D. ①③④
25、A、B、C为主族中的三种原子,它们都能形成离子,且都有相同的电子层结构,其中A离子半径大于B离子半径,C原子半径在三个原子中最小,则A、B、C原子序数的大小不可能为
A A<B<C B B<C<A C A<C<B D C<A<B
26、Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1︰2,则反应中被氧化的Cl2与被还原的Cl2的物质的量之比为
A. 2︰3 B. 4︰3 C. 10︰3 D. 3︰11
27、下列各组物质性质比较中正确的是:A. 溶解度:H2CO3<Na2CO3<NaHCO3
B. 氧化性:Cs+<K+<Na+<Mg2+ C. 酸性:H4SiO4<H3PO4<H2SO4<HClO
D. 稳定性:SiH4<CH4<NH3<HF
28、方志敏烈士生前在狱中曾用米汤给鲁迅先生写信,鲁迅先生收到信后,为了看清信的内容,使用的化学试剂是A 硝酸银溶液 B 碘酒 C 石蕊试液 D 碘化钾淀粉试液
29、苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+(Fe2+易被氧化),现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A 氧化牲 B 还原性 C 碱性 D 酸性
30、据报道:1994年11月9日德国科学家利用数亿个镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天后制得一种新原子![]() X(暂用X表示),这种新元素存在的时间不到千分之一秒。经分析,它属于过渡元素。以下关于对该元素叙述中正确的是A 这种元素与82Pb同一族
X(暂用X表示),这种新元素存在的时间不到千分之一秒。经分析,它属于过渡元素。以下关于对该元素叙述中正确的是A 这种元素与82Pb同一族
B 这种元素肯定是IB族的金属元素C 这种原子的中子数为159 D 这种元素属第六周期元素
31、下列反应的离子方程式可用“H++OH-=H2O”来表示的是A 硫酸和氢氧化钡
B 次氯酸和氢氧化钾 C 硫酸氢钠和氢氧化钠 D 澄清石灰水和盐酸
32、(6分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 。
33、致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O、HF;
第三周期 SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O;CS2 CO2 CCl4 CF4 (选填>或<)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了。
其它类似CF2Cl2的致冷剂还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。
但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。A.毒性 B.沸点 C.易燃性 D.水溶性 E.颜色
34、在水溶液中YO3n-与S2-发生反应的离子方程式如下:
YO3n- + 3S2- + 6H+ == Y- + 3S↓+ 3H2O(已配平)
则YO3n-中Y元素的化合价为 ,Y原子的最外层电子数为 。
35、A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第 周期 族,它的最高价氧化物的化学式为 。
(2)A、B、D的元素符号分别为 、 、 。
(3)A与D形成稳定化合物的化学式为 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
36、实验室用98.0%的密度为1.84g/mL浓H2SO4来配制100mL 1.00mol/L H2SO4。某学生操作步骤如下:A、计算需量取该种浓硫酸的体积;B、检查100mL容量瓶是否漏水;C、量取浓硫酸;D、在容量瓶中先加入少量水,然后将量取的浓硫酸缓缓注入容量瓶中,并用玻璃不断搅拌;E、再将蒸馏水注入容量瓶,至液面接近标线1~2cm时,改用滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻度线相平;F、盖紧瓶塞,反复颠倒,摇匀溶液。请回答了列问题:
(1)请你计算A中所需浓硫酸的体积为 mL。
(2)进行C步操作时,应选用下列量器中的 。
a.50mL量筒 b.25mL碱式滴定管 c.25mL酸式滴定管
(3)上述步骤中 有错,正确的操作应是
。
(4)在C步操作时,若某同学初读数时方法正确,末读数时俯视刻度线,则最终所配溶液浓度 (偏高、偏低或无影响)
(5)用配制好的溶液,再来配制50mL 0.2mol/L的硫酸,需量取原配好的溶液_________mL。
37、短周期元素A、B、C、D中,0.5 mol A元素的离子得到 6.02×1023个电子被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号: A B C D
(2)C一 的离子结构示意图是: ;
(3)D的最高价氧化物的化学式是:
(4)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,叙述你所观察到的现象 , ;写出有关反应的离子方程式:
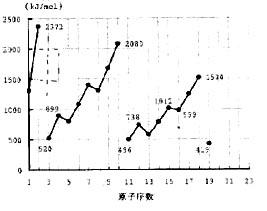 38、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
38、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_________________.各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是______(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<_____
(4)10号元素E值较大的原因是___________________
39、自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为aCuCO3×bCu(OH)2(a,b为正整数,且a£2,b£2)。
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用盐酸物质的量与产生CO2物质的量之比,孔雀石为4:1,石青为3:1。则它们的化学组成为: 孔雀石______________,石青_________________。
(2)今有一分碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO23.36L(标准状况);加热B样品使其完全分解,得到20gCuO,试计算并确定矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO26.72L(标准状况),这份矿样中CuO含量不低于___________g。
(4)设某碳酸盐类铜矿样的质量为Ag,所含CuO质量为Gg。加酸完全溶解后,产生的CO2体积(标准状况)为V L,则含铜矿样的A、V、G之间的关系式为:A=_____________________。
1A 2C 3D 4A 5B 6C 7B 8D 9D 10C 11A 12B 13B 14B 15A
16B 17AB 18B 19B 20C 21D 22C 23B 24C 25B 26D 27BD 28B 29B
30C 31CD
32.Na2O,MgF2,CaCl2,K2S
33(1)CH4>NH3,H2S>HCl
(2) > ,>
(3) CFCl3(或CF3Cl)
(4)使大气臭氧层出现空洞 ABC
34.+5,7
35,(1)三,第七主族 Cl2O7(2) Na,Mg, O (3) Na2O2 (4)2OH-+ Cl2=H2O+ Cl-+ ClO-
36(1)5.43(1分) (2)C(1分) (3)D 将浓硫酸沿烧杯壁倒入盛有水的烧杯中,边倒边搅拌;冷却到室温后再用玻璃榜转移至容量瓶中;洗涤烧杯2~3次,一同转移到容量瓶中。(2分) (4)偏高(1分) (5)10.00(1分)
37(1)Mg Al Cl C(各1分) (3)CO2(1分) (4)开始产生白色沉淀 继而白色沉淀消失至无色溶液 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O(各1分)
38(1)随着原子序数增大,E值变小 周期性 (各1分 共2分)
(2)①③ (各1分 共2分)
(3)419 738 (填E(钾)、E(镁)也给分)(各1分 共2分)
(4)10号元素是氖。该元素原子的最外层电子排布已达到8电子稳定结构。(注:达到8电子稳定结构也给分)
39.CuCO3×Cu(OH)2 2CuCO3×Cu(OH)2 二者混合 36克