第七章 硅和硅酸盐工业
[学习指导]
1、在复习碳及其化合物知识的基础上,了解碳族元素的递变规律,硅、二氧化硅的化学性质。
2、了解水泥、玻璃的用途,制造的主要原料和主要化学反应,根据制取玻璃材料的质量配比计算氧化物组成。
3、对陶瓷、新型无机非金属材料有大致印象。
4、用氧化还原反应的观点分析碳、硅及其化合物的变化。
5、碳、硅及其化合物知识归纳、总结如下:
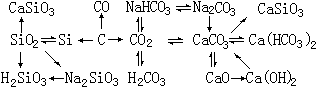
第一节 碳族元素
[课前预习]
1、用原子结构理论、元素周期律来分析、总结碳族元素的性质规律(化合价、原子半径、氧化性、密度、熔、沸点)。
2、重点掌握硅及二氧化硅的性质及应用。
[课堂练习]
1、碳族元素从碳到铅非金属性减弱,金属性增强的原因( )
A、原子序数增加 B、核电荷数增加 C、熔沸点降低 D、原子半径增大
2、碳和硅的比较,正确的是( )
A、都是非金属,但硅的非金属性较强
B、碳和硅的最高正价都是+4价
C、硅元素在地壳的含量占第二位,碳占第一位
D、碳和硅在自然界存在形式都是既有游离态也有化合态
3、下列说法正确的是( )
A、碳族元素随核电荷数的增加,熔点升高
B、碳族元素的稳定化合价是+4价
C、金刚石、石墨、C60都是碳的同素异形体
D、常温时不与任何强酸、强碱反应
4、将过量CO2通入下列溶液中,最终出现浑浊的是( )
A、CaCl2溶液 B、生石灰 C、饱和Na2CO3溶液 D、水玻璃
5、熔融烧碱应选用的容器是( )
A、石英坩埚 B、普通玻璃 C、生铁坩锅 D、陶瓷坩埚
6、下列各物质均属于硅酸盐工业产品的是( )
A、陶瓷、水泥 B、单晶硅、玻璃 C、普钙、漂白粉 D、石膏、石英玻璃
[能力训练]
一、选择题
1、在SiO2+3C==SiC+2CO的反应中,氧化剂与还原剂质量之比是( )
A、35:60 B、60:36 C、1:2 D、1:3
2、常温时,下列物质不与二氧化硅反应的是( )
A、硫酸 B、氢氟酸 C、硝酸 D、氢氧化钾溶液
3、下列物质的浓溶液能用磨口瓶玻璃塞盛装的是( )
A、硫酸 B、水玻璃 C、氢氟酸 D、苛性钾溶液
4、有四种不纯的碳酸钠样品,分别含有杂质且杂质的质量分数相同,取等质量的这四种不纯的碳酸钠与同浓度的足量的盐酸反应,消耗盐酸最多的是( )
A、含(NH4)2CO3 B、含NH4HCO3 C、含K2CO3 D、含NaHCO3
5、用二氧化硅和金属氧化物的形式表示硅酸盐的形成,不正确的是( )
A、钙沸石 [Ca(Al2Si3O10)·3H2O]:CaO·Al2O3·3SiO2·3H2O
B、镁橄榄石[Mg2SiO4]:2MgO·SiO2
C、正长石 [KAlSi3O8]:K2O·Al2O3·3SiO2
D、高岭石 [Al2(Si2O5)(OH)4]:Al2O3·2SiO2·2H2O
二、填空题
6、A、B两元素原子的最外层电子数相等,A与C位于元素周期表中同一周期并能形成化合物AC2,每个AC2含有22个电子,B元素位于第3周期第ⅣA族。则:
(1)A_________、B_________、C_________(写元素符号)
(2)A的单质在不同条件下与C的单质反应的化学方程式__________________。
(3)B与C的化合物与A的单质反应的化学方程式__________________。
7、SiO2中混有CaCO3杂质,除去的方法是__________________。
碘中混有SiO2杂质,除去的方法是__________________。
碳酸氢钠溶液中混有少量的碳酸钠,除去的方法是__________________,反应的离子方程式为__________________。
三、计算题
※8、一种不含其它杂质的硅铁样品若干,研细后放入足量的稀盐酸中,放出的气体体积是相同状况下同样质量的此硅铁样品与足量氢氧化钠溶液反应所放出的氢气体积的6倍。
求此种硅铁中含硅的质量分数。(Si+H2O+2NaOH==NaSiO3+2H2↑)
第二节 硅酸盐工业简介
[课堂练习]
1、下列物质:①钢化玻璃,②水玻璃,③玻璃纸,④石英玻璃,⑤有机玻璃,它们之中主要成分为硅酸盐的是( )
A、①② B、①④ C、③④ D、②④
2、下列有关水玻璃的叙述不正确的是( )
A、它是一种矿物胶,既不能燃烧也不易腐蚀
B、在建筑工业是可用作粘合剂和耐火材料
C、它在空气中易变质,因为SiO32-+CO2+2H2O==H4SiO4↓+CO32-
D、水玻璃的主要成分是二氧化硅
3、生产普通玻璃时,可能发生的主要的化学反应是( )
A、高温时 SiO2+Na2O==Na2SiO3
B、高温时 SiO2+Na2CO3==Na2SiO3+CO2↑
C、高温时 SiO2+Na2CO3==Na2SiO3+CO2↑
D、高温时 4SiO2+Na2CO3+Na2CO3==Na2O2·CaO·6SiO2↑
4、欲观察氢气燃烧的颜色,燃烧管的材料最好是采用( )
A、钠玻璃 B、钾玻璃 C、铜管 D、石英玻璃
5、有两种化合物A、B,在水中的溶解度A>B,现取等质量的A、B分别与足量的盐酸反应,相同条件下放出气体质量相同,则A、B分别为( )
A、KHCO3、CaCO3 B、K2CO3、MgCO3
C、KHCO3、MgCO3 D、Na2CO3、NaHCO3
6、制水泥、陶瓷都需要的原料是( )
A、纯碱 B、石英 C、粘土 D、石灰石
7、硅酸盐水泥的生产过程中要加入一定量的石膏,它的作用是( )
A、作填料 B、调节水泥的硬化速度
C、作催化剂 D、使水泥有硬化的性质
8、主要成分为硅酸盐的是( )
A、钠化玻璃 B、有机玻璃 C、石英玻璃 D、水玻璃
9、下列说法正确的是( )
A、我国从唐代时期就能生产陶瓷
B、化学实验室的坩埚、蒸发皿是陶瓷制品
C、水泥、陶瓷的生产过程都需要混合、成型、干燥、冷却
D、敲打一块石英之后,使之失去天然面而变成没有规则几何外型,但它仍是晶体
二、填空题
10、以含__________的物质为原料,经过__________制成硅酸盐产品的工业叫硅酸盐工业,其主要产品是__________、__________、__________。
11、有三种无色透明的不溶于强酸的坚硬固体A、B、C,当固体A在氧气中燃烧时得到一种气体产物,此气体无色略带酸味,在标准状况下此气体的密度是氧气密度的1.375倍。固体B粉末能缓缓溶于苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,此沉淀干燥后不溶于水的白色粉末,是一种比碳酸还弱的酸。将B与石灰石、纯碱按一定比例混合加热后得到C,C在高温软化无固定的熔点,则A__________、B__________、C__________。
12、盛放烧碱等强碱试剂不能用__________塞,应该用__________塞,其原因是__________,反应的离子方程式为__________。
三、计算题
13、某玻璃厂熔制玻璃配料如下:纯碱53kg,石灰石50kg,石英180kg,试计算:
(1)能制玻璃多少千克?
(2)制得的玻璃中钠、钙、硅的氧化物的物质的量是多少?
第七章质量检测
一、选择题
1、防毒面具中装有活性炭,它能抵抗多种毒气进攻,这是利用活性炭具有的性质是( )
A、还原性 B、吸附性
C、可燃性 D、能将毒气氧化成无毒物质
2、某化合物由A、B两元素组成,如果A、B两元素的原子最外层电子数分别是4和6,则化合物的化学式可能是( )
A、A2B B、AB C、AB2 D、A2B2
3、某元素最高正价和负价绝对值相等,该元素在气态氢化物中的质量分数为87.8%,则此元素为( )
A、S B、N C、C D、Si
4、不能用来加热氢氧化钠的坩埚是( )
A、石英玻璃 B、铁坩埚 C、氧化镁坩埚 D、石墨坩埚
5、普通玻璃中含13%氯化钠、11.7%氯化钙、75.3%二氧化硅,用氧化物的形式表示玻璃的组成为( )
A、Na2O·CaO·SiO B、2Na2O·CaO·SiO2
C、Na2O·CaO·6SiO2 D、Na2O·2CaO·6SiO2
6、在碳族元素中,从上到下逐渐减小或减弱的是( )
A、原子的价电子数 B、气态氢化物的稳定性
C、单质的还原性 D、原子半径
7、关于硅及其化合物的叙述中,不正确的是( )
A、水玻璃可作粘合剂及耐火材料
B、硅可作半导体原料
C、二氧化硅是光导纤维的原料
D、氮化硅是光导纤维的材料
8、下列物质中,没有固定熔点的是( )
A、玻璃 B、金刚石 C、二氧化硅 D、C60
9、只用一种试剂可以鉴别下列溶液:Na2CO3、Na2SiO3、Na2SO4,这种试剂是( )
A、BaCl2 B、NaOH C、酚酞溶液 D、盐酸溶液
10、下列物质在任何条件下都不与二氧化硅反应的是( )
A、烧碱 B、纯碱 C、石灰石 D、盐酸
11、下列几种酸中,酸性最弱的是( )
A、碳酸 B、硅酸 C、磷酸 D、高氯酸
12、属于传统无机非金属材料特性的是( )
A、耐高温 B、有些具有光学特性
C、抗腐蚀性强 D、有些具有生物功能
13、由碳酸钙和碳酸镁组成的混合物充分加热至质量不再减少时,称得残留物质的质量是混合物质量的一半,则残留物中钙、镁两元素的物质的量之比为( )
A、1:1 B、1:2 C、1:3 D、2:1
14、下列物质属于纯净物的是( )
①水玻璃 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水 ⑦液氯
A、①④ B、①⑤ C、①⑤⑥ D、⑤⑦
二、填空题
15、A、B、C是短周期中相邻的三种元素,A、B同周期,B、C同主族,三种元素的最外层电子数之和为13,而质子数之和为27,则A__________、B__________、C__________,它们的气态氢化物的稳定性由弱到强的顺序是____________________,它们的最高价氧化物中,熔点最高的是__________。
16、有一无色透明晶体是高熔点、高硬度的物质,A在纯氧中不能燃烧,但在高温时既能与大理石又能与纯碱反应,都放出气体B,A不能溶于强酸但能溶于氢氟酸,A与烧碱溶液反应生成C的水溶液,B通入C的溶液时,生成不稳定的白色胶状沉淀,在干燥的空气中,失去部分水,得白色粉末D,D加热又生成A,则:
A__________、B__________、C__________、D__________。
三、计算题
※17、6.9g钠和硅4.2g投入适量的水中,在标准状况下能产生氢气多少升?反应后测得溶液的体积为500mL,求溶液的物质的量浓度。(注:Si+H2O+2NaOH==Na2SiO3+2H2↑)
答案:
第一节
[课堂练习]1D 2B 3C 4D 5C 6A
[能力训练]一、1C 2AC 3A 4A 5C
二、1、(1)A:C,B:Si,C:O (2)(3)略
2、加稀盐酸,过滤,洗涤,烘干;加热升华,冷却;
通过量的CO2气体,CO2+H2O+CO32-==2HCO3-
三、4%
第二节
[课堂练习]一、1A 2D 3BC 4D 5A 6C 7B 8AD 9BD
二、10、硅,加热,水泥,玻璃,陶瓷 11、A:C,B:SiO2,C:CaSiO3
12、玻璃,橡胶,玻璃中的主要成份SiO2与NaOH反应。SiO2+2OH-==SiO32-+H2O
三、(1)239kg (2)1:1:6
质量检测
一、1B 2BC 3D 4A 5C 6B 7D 8A 9D 10D 11B 12AC 13C 14D
二、15、A:N,B:C,C:Si;SiH4,CH4,NH3;SiO2
16、A:SiO2,B:CO2,C:Na2SiO3,D:H2SiO3
三、10.08L