高一化学周考试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 Cu 64 Zn 65 Ag 108 Ba 137
第Ⅰ卷(选择题,共54分)
一、 选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列物质中主要成分不是二氧化硅的是 ( )
A.硅胶 B.水晶 C.玛瑙 D.硅石
2.NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中 ( )
A.具有玻璃塞的细口瓶 B.具有玻璃塞的广口瓶
C.带滴管的滴瓶 D.具有橡胶塞的细口瓶
3.下列关于“焰色反应”的理解正确的是 ( )
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.只有某些金属或其化合物才有焰色反应
D.只有金属离子才有焰色反应
4.二氧化硅的化学性质很不活泼,几乎所有的酸都不与其反应,但有一种酸能够和二氧化硅发生反应,这种酸是 ( )
A.浓盐酸 B.硫酸 C.硝酸 D.氢氟酸
5.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
6.下列物质中,不属于合金的是..................................................... ( )
A. 硬铝 B.黄铜 C. 钢铁 D.金箔
7.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是 ①NaHCO3 ②Al2O3③Al(OH)3 ④Al ................................................................................................... ( )
A.③④ B.②③④ C.①③④ D.全部
8.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有.......................................................................................................... ( )
A.![]() B.Cu2+ C.Al3+ D.Mg2+
B.Cu2+ C.Al3+ D.Mg2+
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9. 只用一种试剂可区别![]() 五种溶液, 这种试剂是 ( )
五种溶液, 这种试剂是 ( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
10.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有 ( )
A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
11.下列离子方程式书写正确的是.................................................................. ( )
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:![]()
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
12.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) ............................... ( )
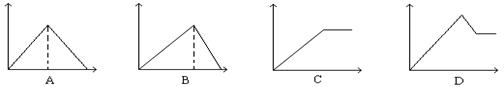
13.下列关于氯水的叙述中,正确的是 ( )
A.新制氯水中既有分子,又有离子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水可以使干燥的布条褪色
14.自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制 ( )
A. Na2SO4 B.NaCl C. AgNO3 D.AlCl3
15.下列物质中,能够与NaOH溶液反应的是 ( )
A.碳酸钠 B.硅酸钠 C.二氧化硅 D.氢氧化铝
16.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为 ( )
A 1︰2 B 3︰2 C 3︰1 D 6︰1
17.wg铁粉和铝粉的混合物,和过量的 NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg。求原混合物中铝粉的质量分数是 ( )
A.30% B.50% C.70% D.90%
18.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是 ( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.木炭(C)和O2
第Ⅱ卷(非选择题,共46分)
三、(本题包括1小题,共10分)
19. (1)鉴别KCl溶液和K2CO3溶液的试剂是 ,
(2)鉴别Na2CO3固体和SiO2固体的试剂是 ,
(3)鉴别CaCO3固体和Na2SiO3固体的试剂是 ,
(4)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,
(5)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,
四、(本题包括1小题,共8分)
20.(8分)A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断
A:________、B:________、C:_________、D:_________、E:
五、(本题包括2小题,共23分)
21.(10分)已知有以下物质相互转化
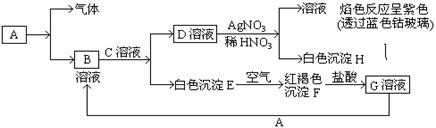
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
22.(13分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
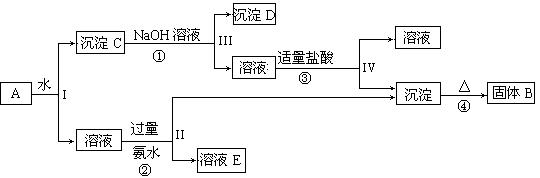
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B ;C ;沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式
① ;② ;
③ ;④ 。
六、计算题(共8分)
23.将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL
0.5mol /LFeSO4溶液和5.2 g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
高一化学周考试题
参考答案
1、A 2、D 3、C 4、D 5、D
6、D 7、D 8、A 9、C 10、D
11、D 12、D 13、AD 14、C 15、CD
16、C 17、A 18、C
19、(1)盐酸 (2)盐酸 (3) 盐酸 ⑷盐酸 ⑸加热
20、A:Na2CO3、B:KOH、C:NaHCO3 D:NaCl、E:Fe(OH)3
21、(1)FeCl2 KCl (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++SCN-=Fe(SCN)2+ 2Fe3++Fe=3Fe2+
22、(1)过滤
(2)Al2O3;Al2O3和Fe2O3; Fe2O3;K2SO4和(NH4)2SO4
(3)①Al2O3+2NaOH=2NaAlO2+H2O
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③NaAlO2+HCl+H2O=Al(OH) 3↓+NaCl
④2Al(OH)
3![]() Al2O3+3H2O
Al2O3+3H2O
23、溶液中含有Fe2+:0.5mol/L ×0.2L=0. 1mol
设反应消耗铁的物质的量为x,生成铜的物质的量为y
Fe + Fe2(SO4)3=3FeSO4 Fe + CuSO4=FeSO4 + Cu
1mol 1mol 3mol 1mol 1mol 1mol 1mol
xmol xmol 3xmol ymol ymol ymol ymol
可得:3x+y==0. 1mol
6g-56x+8y=5.2g
解得x=0.02mol y=0.04 mol
故得:生成铜质量为0.04 mol×64g/ mol=2.56g
原溶液中Fe2(SO4)3物质的量浓度为![]() =0.3mol/L
=0.3mol/L