高一级化学期中试题
可能用到的原子量:H:1 O:16 S:32 Cu:64 Cl:35.5 Ba:137
一、选择题(每小题3分,共60分,每小题只有一个选项符合题意.将正确答案的序号填在后面的表格内)
1、工业上可以不经处理直接排放的气体是
A.SO2 B.Cl2 C.CO2 D.H2S
2、下列各组物质中,两种微粒不具有相同电子总数的是
A、![]() 和
和![]() B、
B、![]() 和
和![]() C、
C、![]() 和
和![]() D、
D、![]() 和
和![]()
3、相同物质的量的H2S和SO2,一定具有相同的
A、原子数 B、质子数 C、体积 D、质量
4、最外层电子数为4的原子,其核电荷数可能为
A、14 B、8 C、12 D、17
5、含有相同质子数和电子数的两种微粒之间的关系不正确的是
A.它们可能是同位素 B.可能是不同的分子
C.可能是不同的离子 D.可能是一种分子和一种离子
6、下列微粒中半径最大的是
A、S B、S- C、Cl- D、K+
7、SO2气体通入下列物质中能产生沉淀的是
A、H2S溶液
B、NaOH溶液
C、氯水 D、NaHCO3溶液
8、下列说法中,正确的是:
A、元素周期表中每一周期都是从碱金属元素开始,惰性元素结束
B、金属元素与非金属元素之间形成的化合物一定是离子化合物
C、含有离子键的物质,一定是离子化合物
D、只含有共价键的物质,一定是共价化合物
9、等体的Na2SO4,KAl(SO4)2和Al2(SO4)3三种溶液分别与同浓度、同体积的BaCl2溶液恰好反应,则上述三种溶液物质的量浓度比为
A.1:2:3 B.3:2:1 C.6:3:2 D.2:3:6
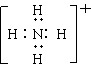
![]() 10、下列微粒的表示式,正确的是
10、下列微粒的表示式,正确的是
A.硫化氢的电子式 B、氯化铵的电子式 Cl-
![]()
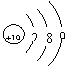 C、钾离子的结构示意图
D、氢氧根离子的电子式
C、钾离子的结构示意图
D、氢氧根离子的电子式
11、若aXm+与bYn-的核外电子排布相同,下列关系式正确的是( )
A、b=a-n+m B、b=a+n-m C、离子半径Xm+<Yn+D、原子半径X<Y
12、能用H++OH-=H2O离子方程式表示的化学反应是
A、NaOH溶液和NaHCO3溶液反应 B、Fe(OH)3和硫酸溶液反应
C、Ba(OH)2溶液和硫酸反应
D、KOH溶液NaHSO4溶液反应
13、下列各种元素中,原子的次外层电子数等于其它各层电子数之和的元素是
A、Mg B、S C、O D、Ar
14、在无色透明的强酸性溶液中,能大量共存的离子组是
A、![]() B、
B、![]()
C、![]() D、
D、![]()
15、为了除去混在CO2气体中的杂质SO2,应选用的试剂是
A、NaOH溶液
B、饱和Na2CO3溶液
C、饱和NaHCO3溶液 D、饱和NaHSO3溶液
16、元素A、B、C原子核内质子数之和为31,最外层电子数之和为17,这三种元素是
A、N、P、Cl B、P、O、S C、N、O、S D、O、F、Cl
17、把3.48gCuSO4·xH2O晶体加热到白色,质量不再改变后,冷却称其质量为2.40g,此晶体中x值应为
A、5 B、4 C、3 D、2
18、对于反应:3S+6KOH=2K2S+K2SO3+3H2O.下列说法中正确的是
A.硫是氧化剂,KOH是还原剂. B.反应中共转移8mol电子.
C.还原剂和氧化剂质量比是2:1. D.氧化产物和还原产物的质量比是1:2.
19、两份质量均为m的硫,分别跟足量的氢气和氧气反应,反应后将生成物混合,生成硫的质量为
A、2m B、1m C、1.5m D、0.5m
20、将等物质的量的SO2和Cl2混合后通入含有品红和Ba(NO3)2的混合溶液里,发生的现象是:①溶液很快褪色 ②溶液不褪色
③有沉淀生成 ④溶液仍然透明
A、仅①和④ B、仅①和③
C、仅②和③ D、仅②和④
高一级
化学期中试题(卷)
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、填空题(本题包括4小题,共24分)
21、比较下列各组元素或化合物的性质(用大、小、强、弱表示):
(1)硫原子的半径比氧原子的半径
.
(2)S2-的还原性比Cl-的还原性 .
(3)H2S的稳定性比H2O的稳定性
.
(4)H2SO4的酸性比HClO4的酸性
.
22、有SO2和H2S的混合气体共2.5mol,充分反应后.测得还原产物比氧化产物少16g,原混合气体中SO2和H2S的物质的量之比是 或 .
23、A+、B2+、C-、D2-四种离子与氩原子的电子排布相同,则这四种离子中半径最大的是(填离子符号) 。这四种离子间形成的离子化合物中式量最大的是(填化学式) 。
24、A、B、C、D、E五种元素在周期表里的位置如下表所示:
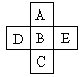
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,其最高价氧化物对应的水化物的化学式为 ;A与B可形成一种通常情况下为气态的化合物,其化学式为 ,该化合与E单质的水溶液反应的离子方式程式为 。
三、实验题.(共9分)
25、为了验证木炭可被浓H2SO4氧化成CO2,选用了图示仪器(含所盛物质),试回答有关问题.(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4).
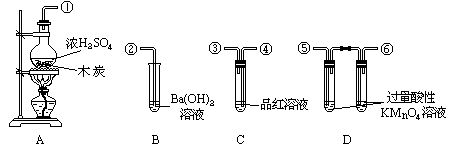
(1)为了验证生成CO2.写出仪器间连接的数字编号.(按气体从左向右顺序)
: 。
(2)仪器B,C中应各有什么现象才能证明有CO2生成:B中 。
C中 。
(3)D中过量酸性KMnO4溶液的作用是 。
七、计算题.(7分)
26、有硫酸钠和碳酸钠的混合物共2.48g,将其溶于水配成溶液加入过量氯化钡溶液反应,将所得沉淀洗净后,放入过量稀硫酸中,产生气体并发现沉淀质量增至4.66g。试求混合物中硫酸钠和碳酸钠的物质的量各是多少mol?