高一年级化学春学期期中考试
试题(重点班)
命题人:杨贵生
相对原子质量:H—1 O—16 C—12
第Ⅰ卷(选择题 共42分)
一、选择题:(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
1、 一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
A. 硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
2、某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键 D.以上说法都不正确
3、乙醇与二甲醚互为同分异构体的依据是
A.具有相似的化学性质 B.具有相同的物理性质
C.分子具有相同的空间结构 D.分子式相同,但分子内碳原子的结合方式不同
4、下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
5、X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出, X 与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为:
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
6、下列选项中说明乙醇作为燃料的优点是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④ C.①③④ D.②③④
二、选择题(本题包括10小题,每小题3分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得3分,但只要选错一个,该小题就为0分)
7、下列各组物质的性质顺序,不正确的是
A.原子半径:Na<Mg<Al B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.熔点:SiO2<NaCl<CO2
8、下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl―和Na+的静电作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.Na和Cl反应生成NaCl后,能量降低
9、用铁片与稀硫酸反应制取氢气时,为使氢气生成速率加快,下列措施正确的是
A.用酒精灯加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4 溶液 D.不用铁片,改用铁粉
10、在2A+B![]() 3C+4D反应中,下列表示该反应速率最快的是
3C+4D反应中,下列表示该反应速率最快的是
A.v (A)=0.5mol(L•min)-1 B.v (B)=0.3mol(L•min)-1
C.v (C)=0.8mol(L•min)-1 D.v (D)=1mol(L•min)-1
11、在一定条件下,可逆反应:A(g)+3B(g) ![]() 2C(g)达到平衡后的标志是
2C(g)达到平衡后的标志是
A、C生成的速率与C分解的速率相等 B、单位时间生成n molA,同时生成3n molB
C、A、B、C的浓度不再变化 D、A、B、C的分子数比为1:3:2
12、人们在生活中不断地利用和消耗能量,下列关于能量转化的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,化学能主要转化为热能
13、我省许多地区都用上“西气东输”的天然气。已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量CH4和CO2产生的温室效应前者大。下面是有关天然气的几种叙述,其中正确的是
①天然气与煤、柴油相比是较清洁的能源 ②燃烧天然气是酸雨成因之一 ③等质量的CH4和CO2产生的温室效应也是前者大
A.只有② B.只有③ C.是①和③ D.①②③
14、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
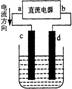 A.a为正极、b为负极
A.a为正极、b为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
15、下列物质不能用加成反应得到的是
A.CH2Cl2 B.CH3CH2Cl C. CH3CH2OH D.CH2ClCH2Cl
16、“神舟六号”飞船用铝粉与NH4ClO4的混合物为固体燃料进行太空姿态调整,点燃时铝粉氧化放热引发下面反应2NH4ClO4==N2(g)+4H2O(l)+Cl2(g)+2O2(g) △H<0,下列叙述错误的是
A.NH4ClO4的分解反应瞬间产生大量高温气体推动航天飞船飞行
B.Cl2 是氧化产物,N2和H2O是还原产物
C.从能量变化上说反应主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
第Ⅱ卷 (非选择题 共58分)
三、(本题包括6小题,共46分)
17、(4分)两种气态烃的混合物共1L,完全燃烧后生成同温同压下CO21.8L,则混合烃中一定含有 (填写名称),该物质的特征反应为 (填反应类型)
18、(8分)已知:A、B、D、E为四种短周期元素,它们的核电荷数A<B<D<E;A与B可生成共价化合物AB2,每个AB2分子中含有22个电子;D元素与A元素为同主族元素,E元素原子的最外层电子数比次外层少1个。试回答下列下列问题:
⑴写出AB2的电子式 ;
⑵写出A与E形成的共价化合物的结构式_____________
⑶写出E-的结构示意图 ;
⑷D元素和B元素也能形成DB2型共价化合物,但它与AB2相比,在物理性质却有着巨大反差。请你从结构上给予合理的解释 。
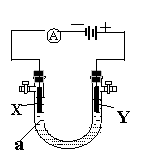 19、(12分)电解原理在化学工业中有广泛应用。右图表示
19、(12分)电解原理在化学工业中有广泛应用。右图表示
一个电解池,装有电解液a,X、Y都是惰性电极,通
过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开
始时,同时在两极各滴入几滴酚酞试液,则
①电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
⑵如果用电解法精炼铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为
②Y电极的材料是 ,电极反应式为
(说明:杂质发生的电极反应不必写出)
20、(6分)在下列事实中,什么因素影响了化学反应的速率
⑴集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
⑵黄铁矿煅烧时要粉碎成矿粒
⑶加热KClO3时放出气泡很慢,加入少量MnO2很快产生气体
⑷同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢
⑸同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同
⑹夏天的食品易霉变,而在冬天就不易发生该现象
21、(8分)有效地利用现有能源和开发新能源已受到各国的重视。(1)1980年我国首次制得一辆燃氢汽车,乘员12人,以50Km/h行驶了40Km。为有效发展用氢能源,首先必须制得廉价的氢气,下列可供开发又比较经济的制氢方法的是 (填编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制取氢气后还需要解决的问题是 。
(2)已知①CH3OH的燃烧热为725.8KJ•mol-1 CH4的燃烧热为890 KJ•mol-1 ②常压下甲烷的沸点是-164℃,甲醇的沸点是65℃。你认为用甲烷作燃料好,还是把甲烷转化为甲醇作燃料好?并说明理由 。
22、(8分)在一支试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中。试回答下列问题。
⑴实验中观察到的现象是
⑵产生上述现象的原因是
⑶写出有关反应的离子方程式
⑷由实验推知:MgCl2溶液与H2的总能量 (填“>”, “<”或 “=”)镁片和盐酸的总能量。
四、(本题包括2小题,共12分)
23、(4分)标准状况下,将11.2L乙烯和乙炔的混合气体通入足量的溴的四氯化碳溶液中,溶液增重13.4g,求乙烯和乙炔的体积各为多少?
24、(8分)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+ B(g) ![]() xC(g)+
2D(g),经过5min后,测得D的浓度为0.5mol/L,且C(A):C(B)=3:5,C平均反应速率是0.1mol(L•min)-1
xC(g)+
2D(g),经过5min后,测得D的浓度为0.5mol/L,且C(A):C(B)=3:5,C平均反应速率是0.1mol(L•min)-1
求:(1)此时A的浓度及反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率
(3)x值是多少?
高一化学![]()
 春学期期中考试
春学期期中考试
答案卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| |||
| 答案 |
| |||||||||
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | ||||||||||
第Ⅰ卷(选择题 共42分)
第Ⅱ卷 (非选择题 共58分)
三、(本题包括6小题,共46分)
17、 ,
18、⑴ ⑵_____________ ⑶ ;
⑷ 。
19、⑴① ; 。
② , 。
⑵① ,
② ,
20、⑴ ⑵ ⑶
⑷ ⑸ ⑹
21、(1) ; 。
(2)
。
22、⑴ ⑵
⑶ ⑷
四、(本题包括2小题,共12分)
注意:(1—16班选做23A及24小题,17—21选做23B及24小题,选错但做对不给分)
23A、
23B、
24、
春学期期中考试
高一年级化学试题
命题人:杨贵生
相对原子质量:H—1 O—16 C—12 N—14 S—32 Na—23 Ca—40 Cu—64
第Ⅰ卷(选择题 共42分)
一、选择题:(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
1、 一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
A. 硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
2、元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
3、构成下列四种物质的微粒间,既存在离子键又存在共价键的是
A.K2S B.Na2O2 C.MgCl2 D.SO3
4、下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
5、X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出, X 与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为:
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
6、下列选项中说明乙醇作为燃料的优点是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④ C.①③④ D.②③④
二、选择题(本题包括10小题,每小题3分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得3分,但只要选错一个,该小题就为0分)
7、下列各组物质的性质顺序,不正确的是
A.原子半径:Na<Mg<Al B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.熔点:SiO2<NaCl<CO2
8、下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl―和Na+的静电作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.Na和Cl反应生成NaCl后,能量降低
9、用铁片与稀硫酸反应制取氢气时,为使氢气生成速率加快,下列措施正确的是
A.用酒精灯加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4 溶液 D.不用铁片,改用铁粉
10、在2A+B![]() 3C+4D反应中,下列表示该反应速率最快的是
3C+4D反应中,下列表示该反应速率最快的是
A.v (A)=0.5mol(L•min)-1 B.v (B)=0.3mol(L•min)-1
C.v (C)=0.8mol(L•min)-1 D.v (D)=1mol(L•min)-1
11、在一定条件下,可逆反应:A(g)+3B(g) ![]() 2C(g)达到平衡后的标志是
2C(g)达到平衡后的标志是
A、C生成的速率与C分解的速率相等 B、单位时间生成n molA,同时生成3n molB
C、A、B、C的浓度不再变化 D、A、B、C的分子数比为1:3:2
12、沼气是一种能源,它的主要成分是CH4,0.5mol CH4完全燃烧,生成CO2气体和液态H20时,放出445KJ热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)→2CO2(g)+4H2O(l) △H=+890 KJ•mol-1
B.CH4(g)+2O2(g)→CO2(g)+2H2O(l) △H=+890 KJ•mol-1
C.CH4(g)+2O2(g)→CO2(g)+2H2O(l) △H=—890 KJ•mol-1
D.![]() CH4(g)+ O2(g)→
CH4(g)+ O2(g)→![]() CO2(g)+ H2O(l) △H—890 KJ•mol-1
CO2(g)+ H2O(l) △H—890 KJ•mol-1
13、我省许多地区都用上“西气东输”的天然气。已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量CH4和CO2产生的温室效应前者大。下面是有关天然气的几种叙述,其中正确的是
①天然气与煤、柴油相比是较清洁的能源 ②燃烧天然气是酸雨成因之一 ③等质量的CH4和CO2产生的温室效应也是前者大
A.只有② B.只有③ C.是①和③ D.①②③
14、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
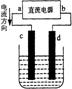 A.a为正极、b为负极
A.a为正极、b为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
15、下列物质不能用加成反应得到的是
A.CH2Cl2 B.CH3CH2Cl C. CH3CH2OH D.CH2ClCH2Cl
16、“神舟六号”飞船用铝粉与NH4ClO4的混合物为固体燃料进行太空姿态调整,点燃时铝粉氧化放热引发下面反应2NH4ClO4==N2(g)+4H2O(l)+Cl2(g)+2O2(g) △H<0,下列叙述错误的是
A.NH4ClO4的分解反应瞬间产生大量高温气体推动航天飞船飞行
B.Cl2 是氧化产物,N2和H2O是还原产物
C.从能量变化上说反应主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
第Ⅱ卷 (非选择题 共58分)
三、(本题包括6小题,共46分)
17、(4分)两种气态烃的混合物共1L,完全燃烧后生成同温同压下CO21.8L,则混合烃中一定含有 (填写名称),该物质的特征反应为 (填反应类型)
18、(8分)已知:A、B、D、E为四种短周期元素,它们的核电荷数A<B<D<E;A与B可生成共价化合物AB2,每个AB2分子中含有22个电子;D元素与A元素为同主族元素,E元素原子的最外层电子数比次外层少1个。试回答下列下列问题:
⑴写出AB2的电子式 ;
⑵写出A与E形成的共价化合物的结构式_____________
⑶写出E-的结构示意图 ;
⑷D元素和B元素也能形成DB2型共价化合物,但它与AB2相比,在物理性质却有着巨大反差。请你从结构上给予合理的解释 。
 19、(12分)电解原理在化学工业中有广泛应用。右图表示
19、(12分)电解原理在化学工业中有广泛应用。右图表示
一个电解池,装有电解液a,X、Y都是惰性电极,通
过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开
始时,同时在两极各滴入几滴酚酞试液,则
①电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
⑵如果用电解法精炼铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为
②Y电极的材料是 ,电极反应式为
(说明:杂质发生的电极反应不必写出)
20、(6分)在下列事实中,什么因素影响了化学反应的速率
⑴集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
⑵黄铁矿煅烧时要粉碎成矿粒
⑶加热KClO3时放出气泡很慢,加入少量MnO2很快产生气体
⑷同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢
⑸同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同
⑹夏天的食品易霉变,而在冬天就不易发生该现象
21、(8分)有效地利用现有能源和开发新能源已受到各国的重视。(1)1980年我国首次制得一辆燃氢汽车,乘员12人,以50Km/h行驶了40Km。为有效发展用氢能源,首先必须制得廉价的氢气,下列可供开发又比较经济的制氢方法的是 (填编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制取氢气后还需要解决的问题是 。
(2)已知①CH3OH的燃烧热为725.8KJ•mol-1 CH4的燃烧热为890 KJ•mol-1 ②常压下甲烷的沸点是-164℃,甲醇的沸点是65℃。你认为用甲烷作燃料好,还是把甲烷转化为甲醇作燃料好?并说明理由 。
22、(8分)在一支试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5mL盐酸于试管中。试回答下列问题。
⑴实验中观察到的现象是
⑵产生上述现象的原因是
⑶写出有关反应的离子方程式
⑷由实验推知:MgCl2溶液与H2的总能量 (填“>”, “<”或 “=”)镁片和盐酸的总能量。
四、(本题包括2小题,共12分)
注意:(1—16班选做23A及24小题,17—21班选做23B及24小题,选错但做对不给分)
23A、(4分)在标准状况下,5.6L气态烃充分燃烧,生成22gCO2和13.5gH2O,求该烃的分子式。
23B、(4分)标准状况下,将11.2L乙烯和乙炔的混合气体通入足量的溴的四氯化碳溶液中,溶液增重13.4g,求乙烯和乙炔的体积各为多少?
24、(8分)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+ B(g) ![]() xC(g)+
2D(g),经过5min后,测得D的浓度为0.5mol/L,且C(A):C(B)=3:5,C平均反应速率是0.1mol(L•min)-1
xC(g)+
2D(g),经过5min后,测得D的浓度为0.5mol/L,且C(A):C(B)=3:5,C平均反应速率是0.1mol(L•min)-1
求:(1)此时A的浓度及反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率
(3)x值是多少?