高一年级化学第二学期期末模拟考试
试卷
试卷总分150分 考试时间120分钟 06.6
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
2.可能用到的相对原子质量:H:1;C:12;O:16;Fe:56
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意。)
1.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
2.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
3.共价键、离子键和范德华力都是微粒之间的不同作用力,下列晶体中同时含有上述两种结合力的是
① Na2O2 ② SiO2 ③ 石墨 ④ 金刚石 ⑤ NaCl ⑥ C60
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
4. 下列关于乙烯和聚乙烯的叙述不正确的是
A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物
B.乙烯的化学性质比聚乙烯活泼
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.乙烯和聚乙烯都能使溴水褪色
5. 在下面的电子结构中,第一电离能最小的原子可能是
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
6.在下列分子中,存在手性碳原子的是
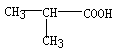
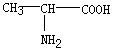 A.
B.
A.
B.
![]() C.
C. ![]() D.
D.
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
8.键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键断裂和新键形成的过程。现查得:H—H、Cl—Cl和H—Cl的键能分别为436、243和431 kJ· mol-1,请用此数据估计,由Cl2、H2生成1 mol HCl时的热效应
A.放热183kJ B.放热91.5kJ
C.吸热183kJ D.吸热91.5kJ
9.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C ![]() 2AlN + 3CO下列叙述正确的是
2AlN + 3CO下列叙述正确的是
A.氮化铝是一种平面层状结构的晶体
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
D.氮化铝晶体属于原子晶体
10. 以下现象与核外电子的跃迁有关的是①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
11.关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
12.从海水里提取溴的过程中,有如下反应:
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是
A.2NaBr+Cl2=Br2+2NaCl B.Br2+SO2+2H2O=2HBr+H2SO4
C.2H2S+SO2=3S+2H2O D.Cl2+H2O=HCl+HClO
13.天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些。若要将它们液化,下列说法正确的是
A.贫气易液化 B.富气易液化
C.二者液化条件相同 D.加压降温均有利于两者液化
14.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂。常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得,下列有关说法正确的是
A.S2Cl2分子空间构型为正四面体形
B.固态时S2Cl2属于原子晶体
C.S2Cl2水解的化学方程式可能为:2S2Cl2 +2H2O== 4HCl + SO2↑ + 3S↓
![]() D.S2Cl2的电子式为:
D.S2Cl2的电子式为:
15.下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO![]() 2Hg+O2↑
B.2Al+3MnO2
2Hg+O2↑
B.2Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO![]() 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共32分)
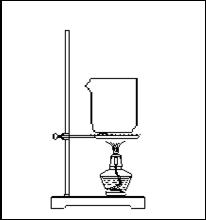 16.(18分)课本中有这样一段:“苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。”某同学欲探究苯与水沸点的高低,设计了如下的实验装置:
16.(18分)课本中有这样一段:“苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。”某同学欲探究苯与水沸点的高低,设计了如下的实验装置:
⑴请你在方框内补全该同学的装置图,
指出仪器中所盛试剂的名称。
⑵该同学根据实验中出现
的现象来判断苯与水沸点的高低。
⑶写出实验室中制取硝基苯的反应式:
。
⑷写出碳原子的基态电子排布式
苯分子中碳原子的杂化形式为
在苯分子中共有 个σ键,
苯分子的构型为
苯的熔沸点比水的溶沸点低的原因是
17.(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
⑴一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列关于同主族元素所形成物质的推理中不正确的是 ;
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2能置换出NaI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
E.所有主族元素的原子形成简单阳离子时的正价数都与它的族序数相等
⑵表中N元素形成的单质的电子式为 ;
As的原子结构示意图是 ;
| C | N | O | F | ||
| Si | P | S | Cl | ||
| Ge | As | Se | Br | ||
| Sn | Sb | Te | I | ||
| Pb | Bi | Po | At | ||
⑶根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱 > ; As、Se气态氢化物的稳定性 > ;
⑷现有某非金属元素R,若其原子最外层电子数为x,写出R形成的简单阴离子的化学式 ;
⑸在一定的条件下,S与H2反应有一定的限度(可理解为反应进行的程度),请判断在相同的条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
四、(本题包括4小题,共42分)
18.(14分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期中金属性最强的元素。试回答下列问题:
⑴A在元素周期表中的位置_______________;
⑵D元素的名称是 ,该元素的最高价氧化物的化学式为 ;
⑶A、B、C三种元素形成的简单离子的半径由大到小的顺序是_______________(填写离子符号);
⑷CA2与D元素的单质在水溶液中反应的离子方程式是__________________;
⑸C元素常见的化合价有—2、+2、+4、+6等,C与A、B、D形成的很多化合物中,各原子(或离子)都满足最外层8电子稳定结构,请你大胆猜想,写出其中两种化合物的化学式 _________、___________;
⑹选择⑸中的一个答案,用电子式表示其形成过程:
。
19.(10分)某有机物A由C、H、O三种元素组成,15g A完全燃烧可生成22g CO2 和9g水。试求:
⑴该有机物的最简式 。
⑵若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A. 一定互为同系物 B. 一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D. 等物质的量的它们完全燃烧耗氧量相同
⑶若A与碳酸钠溶液反应有气体放出,则该反应的化学方程式为:
。
⑷若A是具有水果香味的液体,可发生水解反应,则A的结构简式为 。
⑸若A的相对分子质量为180,能发生银镜反应,也能发生酯化反应,则A的分子式为 。
20.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应:
。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e—结构,且含有非极性键)的电子式 。
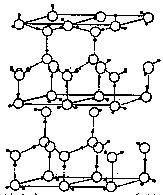 21.(10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
21.(10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
⑴1 mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11kJ•mol—1)。已知冰的升华热是51 kJ•mol—1,则冰晶体中氢键的能量是 kJ•mol—1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是_______________________________。
五、(本题包括2小题,共16分)
22.(6分)现用30g普通冰醋酸(CH3COOH)与28g含有18O的乙醇(CH3CH218OH)在浓硫酸存在的条件下加热制取乙酸乙酯,如果实际产量是理论产量的80%,可制取乙酸乙酯多少克?
23.(10分)已知Fex O晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,x值小于1。测知Fex O晶体密度ρ为5.71 g·cm-3,晶胞边长为:
4.28×10-10m。求
(1)FexO中x值(精确至0.01)为多少?
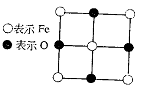 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(3)在完整晶体中,与O2-等距且最近的6个Fe占据空隙是何种几何形状?
(4)在晶体中,铁元素的离子间最短距离为多少米?
第二学期高一年级期末模拟考试
化学试卷答题纸
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共32分)
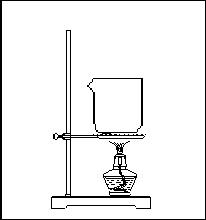 16.(18分) ⑴(见图)⑵
16.(18分) ⑴(见图)⑵
⑶ 。
⑷ 、 、
、 、
17.(14分)⑴ ;
⑵ ; ;
⑶ > ; > ;
⑷ ;⑸ 。
四、(本题包括4小题,共42分)
18.(14分)⑴ ;⑵ , ;⑶ ;
⑷ ;⑸ _________、___________;
⑹ 。
19.(10分)⑴ 。⑵ (填序号)
⑶ 。
⑷ 。⑸ 。
20.(8分) ⑴ 。
⑵① ;
② 。
⑶ 。
21.(10分)⑴ ⑵ 。
⑶ ⑷ ,__________________________________。
五、(本题包括2小题,共16分)
22.(6分)
23.(10分)
(1)
(2)
(3)
(4)