高一年级化学第二学期期中考试2
试卷
可能用到的原子量: H-1 C-12 N-14 O-16 S-32 Cl-35.5 Mn-55
Zn-65 K-39 Na-23 Mg-24 Al-27 Ca-40 Br-80
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1、13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich 等人为此获得2002年度诺贝尔化学奖。下面有关13C、15N的叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
2、设NA表示阿伏加德罗常数,下列说法中不正确的是( )
A.18gNH4+含有的电子数为11NA
B.NA个H2SO4分子和NA个H3PO4分子的质量比为1∶1
C.3.9g金属钾变为K+时失去的电子数为0.1NA
D.在标准下,11.2LN2含有的原子数为NA
3、下列关于氯水的叙述正确的是( )
A、新制氯水可使蓝色石蕊试纸先变红后褪色 B、新制氯水中只有Cl2和H2O分子
C、氯水放置数天的酸性将变弱 D、光照氯水有气泡逸出,该气体是Cl2
4、在标准状况下盛满HCl和N2混合气体的烧瓶,用喷泉的方法充水直至喷泉结束,如果HCl均留在烧瓶中,已知HCl完全溶于水中,则所得盐酸的物质的量浓度是( )
A.1mol/L B.0.5mol/L
C.0.45mol/L D.0.045mol/L
5、自来水可以用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A.NaBr B.NaOH C.NaHCO3 D.FeCl3
6、下列物质含有共价键的离子化合物是( )
A. MgCl2 B. H2SO4 C. KOH D. HCl
7、将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为( )
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
8、 根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O→H2SO4+2HI 2FeCl2+Cl2→2FeCl3 2FeCl3+2HI→2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
9、在A.B.C.d四个集气瓶中盛有H2、Cl2、HCl、HBr中的任一种气体。若将a和d 两瓶气体混合后见光爆炸;若将a和b两瓶气体混合后,瓶壁上出现暗红色小液滴。则A、B、C、d四个集气瓶中分别盛放的气体是( )
A.Cl2、H2、HCl、HBr B.Cl2、HCl、HBr、H2
C.Cl2、HBr、H2、HCl D.Cl2、HBr、HCl、H2
10、随着核电荷数的递增,卤族元素的性质递变规律正确的是( )
①单质颜色加深 ②单质沸点升高 ③单质氧化性增强 ④原子半径增大
⑤气态氢化物稳定性增强 ⑥离子的还原性增强
A、①②③ B、④⑤⑥ C、①②④⑥ D、①②③④⑤⑥
二、选择题(本题包括5小题,每小题3分,共15分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
11、在一定条件下发生如下反应: 2KClO3+I2 → 2KIO3+Cl2,则下列推断正确的是( ) A.该反应属于置换反应 B.该反应中KClO3被还原为Cl2
C.该反应中还原剂为KClO3 D.该反应中氧化剂为I2
12、同温同压下,等质量SO2和CO2相比较,下列叙述中正确的是( )
A.密度比为16∶11 B.密度比为11∶16
C.体积比为1∶1 D.体积比为11∶16
13、实验室里需用480mL0.1mol/L的CuSO4溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68gCuSO4、加入500mL水 B.称取12g胆矾,配成500mL溶液
C.称取8.0gCuSO4、加入500mL D.称取12.5g胆矾、配成500mL溶液
14、取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A、Ⅰ中溶液分层 B、II中溶液分层
C、Ⅲ中溶液分层,下层呈棕色 D、Ⅳ中溶液不分层,溶液由棕色变成黄绿色。
15、用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是( )
A.在烧杯中溶解时,有少量液体溅出 B.样品中含有少量Na2O杂质
C.容量瓶使用前未干燥 D.定容时仰视容量瓶刻度线
三、填空题(29分)
16、工业上是用______和_________反应制取漂白粉,其反应的化学方程式表示为________________________________________。这反应的氧化剂是______________,还原剂是_____________.漂白粉的有效成分是_________。
17、(1) 3.2 g XO2中含有0.1 mol的氧原子,则X的摩尔质量为 。
(2) 在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 ,SO42-的物质的量浓度为 。
(3) 配制800mL 63%的硝酸(密度1.4g/ cm3)需浓度为96%的硝酸(密度1.5g/cm3) ________mL。
(4)写出下列物质的电离方程式:
H2CO3 NaHCO3
NaHSO4 Al2(SO4)3
18、已知2KMnO4 + 16HCl→2KCl + 5Cl2↑+2MnCl2 + 8H2O , 若在上述反应中电子转移了
3 mol,则产生Cl2 L(标准状况),还原剂反应了 mol,KMnO4 反应了 mol。
19、有一包白色固体可能是NaCl、NaI、CuSO4、Na2SO4中的一种或几种物质组成,取上述少量固体,溶于水得无色溶液,并进行如下实验:
(1)在上述溶液中加入足量的氯水,溶液变棕黄色,再加入少量汽油,振荡,静置,油层呈紫红色;
(2)对(1)中所得液体进行分液处理,取水层并加入适量的AgNO3溶液,有白色沉淀生成,再加过量的稀硝酸沉淀不溶解;
(3)过滤上述混合物,在滤液中加Ba (NO3)2溶液,没有沉淀产生。
试判断,原混合物中一定存在的物质是 ,肯定不存在的物质是 , 可能存在的物质是 . (均用化学式表示)。
四、实验题(10分)
20、实验室用下列仪器和药品制取干燥纯净的氯气。
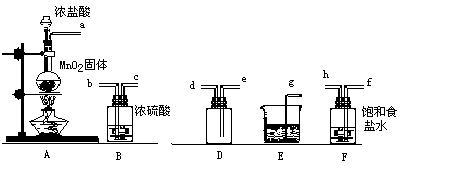
(1)、按气流从左到右,装置正确的连接( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
(2)装置F的作用是 ,
装置E的作用是 。
(3)装置A和E中的反应化学方程式为
A 。
E 。
(4):若A中有4.48L氯气产生(标准状态下),则被氧化的HCl有 g。
五、计算题(16分)
21、取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr的水溶液中,经加热蒸发水分并烘干后,得质量为13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2多少克?
(3)软锰矿含MnO2的质量分数。
22、87.75g食盐与18mol/L的浓硫酸55.5mL混合微热后能生成HCl气体多少mol?在加热到600℃反应后生成多少mol的HCl气体?若将两次生成的HCl用219g水吸收,生成密度为1. 098g/L,求盐酸的物质的量浓度?
第二学期期中考试
高一年级化学答题纸
一、选择题(30分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
二、选择题(15分)
| 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
|
三、填空题(29分)
16、(7分) , , ,
, , 。
17、(12分) (1) 。
(2) , 。
(3) mL。
(4) H2CO3 NaHCO3
NaHSO4 Al2(SO4)3
18、(6分) L, mol, mol。
19、(4分)一定存在的物质是 ,肯定不存在的物质是 , 可能存在的物质是 . (均用化学式表示)。
四、实验题(10分)
20、(1)、按气流从左到右,装置正确的连接( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
(2)装置F的作用是 ,装置E的作用是 。
(3)装置A和E中的反应化学方程式为
A 。
E 。
(4)若A中有4.48L氯气产生(标准状态下),则被氧化的HCl有 g。
五、计算题(16分)
21、(7分)
22、(9分)