高一年级化学第二学期期中考试
试题
可能用到的相对原子质量:C-12、Si-28、S-32、Fe-56、O-16
一、选择题(每题只有一个正确答案,填入答题卡中。1~10题每题2分,11~20题每题3分)
1、 某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为
A、6 B、15 C、14 D、17
2、 某元素的阴离子Rn-核外m个电子,质量数为A,则R原子的原子核中的中子数为:
A、A+m-n B、A-m+n C、A+m+n D、A-m-n
3、 在下列元素中,最高正化合价数值最大的是:
A、Na B、P C、F D、Ar
4、 在下列元素中,原子半径最小的是:
A、N B、Cl C、Mg D、F
5、元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是:
A、XY2 B、X2Y3 C、X3Y2 D、X2Y
6、某元素R的最高价氧化物对应水化物的化学式为H2RO3,但R的气态氢化物中氢的质量分数为25%,此元素为:
A、C B、N C、Si D、S
7、下列各组物质中,互为同素异形体的是:
A、水和过氧化氢 B、C60和C70 C、16O和18O D氯水和液氯
8、下列物质中既有离子键,又有共价键的是:
A、O3 B、H2O2 C、CaF2 D、KOH
9、下列单质中,属于半导体的是:
A、O2 B、S C、Se D、Te
10、在一定的条件下,下列物质能与硫发生反应,且硫作为还原剂的是:
A、O2 B、H2 C、Fe C、Cu
11、下列气体中,能污染大气,形成酸雨,但可以用碱溶液吸收的是:
A、CO2 B、CO C、SO2 D、N2
12、在下列变化中,不属于化学变化的是
A、 SO2使品红溶液褪色 B、活性炭是红墨水褪色
C、O3使某些染料褪色 D、H2O2使有色布条褪色
13、A、B两主族元素属于同一周期,它们的原子能结合形成化学式为AB2型离子化合物,A、B元素在周期表中的族序数可能为
A、ⅠA、ⅤA B、ⅠA、ⅦA C、ⅡA、ⅦA D、ⅣA、ⅥA
14、有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b;阴离子所带的电荷数c>d。则四种元素的原子序数关系是:
A、a>b>c>d B、b>a>d>c C、c>b>a>d D、b>a>c>d
15、下列关于氧族元素性质的叙述中,正确的是:
A、 都能生成+6价化合物 B、都能与金属直接化合
C、原子的最外层电子数都是6 D、单质都能与H2直接化合生成稳定的氢化物
16、A、B为除第一周期外的短周期元素,可形成AmBn离子化合物,其离子均满足稀有气体元素原子的稳定结构,若A的核电荷数为a,则B的核电荷数不可能为:
A、a-8+m-n B、a+m+n C、a+16-m-n D、a-m-n
17、X和Y属短周期元素,Y原子的最外层电子数是次外层电子数的3倍Y和X同一主族,则有关X、Y的叙述错误的是:
A、 X和Y能形成XY2和XY3型化合物 B、X非金属性比Y强
C、X的最高价氧化物的化学式为H2XO4 D、X可形成X2和X3两种单质
18、短周期元素X、Y、Z在周期表中的位置关系如图所示,据此下列判断正确的是:
| X | ||
| Y | ||
| Z |
A、 Z一定是活泼金属
B、 B、X的最高价氧化物对应的水化物是一种强酸
C、 Y的单质可与水发生剧烈反应,并有气体放出
D、Y和Z和单质均可形成气态氢化物(假如为HnY和HmZ),则稳定性HnY<HmZ
19、一种粒子的质子数和电子数分别与另一种粒子的质子数和电子数相同,则下列说法中错误的是:
A、 可能是不同的分子 B、可能是一种离子和一种分子
C、可能是不同的离子 D、可能是不同的原子
![]() 20、氢化钠(NaH)是一种白色的离子化合物,其中钠为+1价,氢化钠与水反应放出H2,下列叙述正确的是:
20、氢化钠(NaH)是一种白色的离子化合物,其中钠为+1价,氢化钠与水反应放出H2,下列叙述正确的是:
![]()
![]()
![]() A、NaH的电子式为Na+ [ H ] -
B、NaH在水中酸性
A、NaH的电子式为Na+ [ H ] -
B、NaH在水中酸性
C、NaH中氢离子半径比锂离子半径大 D、NaH中氢离子可被还原成氢气
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题(33分)
![]()
![]() 21(3分)、氟利昂是冰箱的制冷剂,它是一种有机物,代表分子式为cl2F2,氟利昂易挥发,进入大气后上升到平流层,在太阳紫外线的作用下光分解出氯原子(Cl),它能促使O3转化为O2,其反应为:Cl+O3
ClO+O2,ClO+O Cl+O2,
21(3分)、氟利昂是冰箱的制冷剂,它是一种有机物,代表分子式为cl2F2,氟利昂易挥发,进入大气后上升到平流层,在太阳紫外线的作用下光分解出氯原子(Cl),它能促使O3转化为O2,其反应为:Cl+O3
ClO+O2,ClO+O Cl+O2,
(1)写出总反应式国
(2)该反应中Cl充当:( )
A、反应物 B、生成物C、氧化剂 D、催化剂
22(6分)、在水溶液中YO3n-和S2-发生反应的离子方程式如下:
YO3n-+3S2-+6H+ ==Y-+3S↓+3H2O
(1) YO3n-中Y元素的化合价是:
(2)Y元素原子的最外层电子数是:
(3)S2-和Y-的还原性强弱为:
23(4分)、若将来发现117号元素,试根据有关元素周期律和元素表知识回答:
(1)117号元素在现在的周期静听应位于 周期和 族
(2)117号元素应是 元素(填金属或非金属)
(3)117号元素(用X表示元素符号)最高价氧化物对应的水化物的化学式为:
24(12分)、A、B、C三种元素的原子具有相同的电子层数,已知B的核电荷数比A多2个,C原子核中的质子数比B多4个;1mol单质A跟酸完全反应,能置换出1gH2,这时A转化成具有跟Ne相同的电子层结构的离子,根据上述条件回答:
(1)A是 元素;B是 元素;C是 元素
(2)A、B元素的最高价氧化物对应的水化物的化学式分别是 和 ;C元素气态氢化物的水溶液俗称 。上述三种化合物相互反应的离子方程式分别是 ; ; 。
25(共8分)、常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间有如下图所示的转化关系,试回答:

 B
B![]()
![]()
O2 O2
![]() A O 2
C
A O 2
C
(1)A是;B是;C是;
(2)若B的物质的量为a,O2的物质的量为b,则:
①(普通班做)当B跟氧气恰好完全反应转化为A时,a和b的数值关系应为。
②(实验班做)当B转化为C时,若反应后常温下体系中只有一种气体,则a和b的数值关系应为。
26、下图虚线框中的装置可用来检验硫酸与木炭在加热条件下反应产生的所有气体产物(SO2、CO2、H2O)填写下列空白:
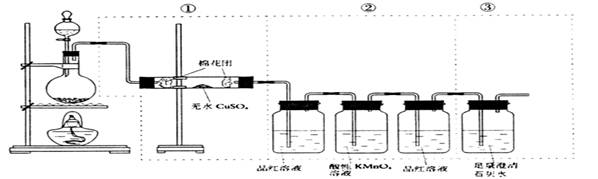
(1)写出浓硫酸和木炭加热反应的化学方程式; ;
(2)如图将装置中①②③三部分仪器的连接顺序变为②①③则可以检验出的物质是 ;(CuSO4不与CO2、SO2反应,与H2O作用变成蓝色晶体)
(3)如图将仪器的连接顺序为①③②,则可以检验出的物质是 ;
(4)如图将仪器的连接顺序为②③①,则可以检验出的物质是 ;
四、计算题(共8分)
27(实验班做)、将8.8gFeS固体置于200ml2.0mol·L-1的盐酸中,以制备H2S气体反应的方程式为
FeS+2HCl==FeCl2+H2S↓。反应完全后(盐酸有剩余),若溶液中H2S的物质的量浓度为0.10mol·L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况)
(2)反应后溶液中Fe2+和H+的物质的量浓度。
(普通班做)某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤100t,计算:
(1)如果煤中的硫全部转化为SO2,每天可产生的SO2的质量。
(2)这些SO2在标准状况下的体积。