|
命题:徐雷
说明: (1)第Ⅰ卷的答案用2B铅笔填涂在机读卡上。
(2)第Ⅱ卷的答案做在答题纸上。
(3)附加题理科实验班的学生必须做,并且其分数计入总分。
可能用到的相对原子质量:Mg 24 K 39 Cl 35.5 H 1 S 32 O 16 N 14
S 32 C 12 Al 27
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个正确答案,每小题3分,16题共48分)
1.碱金属元素化学性质相似的根本原因是 ( )
A.都是金属
B.都能与酸反应
C.最外层电子数都是1个
D.都能与水反应生成碱和氢气
2.下列变化中,需加入还原剂的是 ( )
![]()
![]() A.Fe3+ Fe2+
B.2Cl—-
Cl2
A.Fe3+ Fe2+
B.2Cl—-
Cl2
![]()
![]() C.NH4+ NH3
D.HCO3— CO2
C.NH4+ NH3
D.HCO3— CO2
3.下列各组离子能在呈碱性的溶液中大量共存的是( )
A.H+、K+、Cl—、SO42- B.Ba2+、Na+、Cl—、NO3—
C.Na+、CO32—、HCO3—、NO3— D.Cu2+、Na+、Cl—、SO42—
4.下列离子方程式中,书写正确的是( )
A.稀硫酸滴在铁片上:2Fe+6H+ ==2Fe3++3H2↑
B.碳酸钙与盐酸混合:CO32—+2H+==H2O+CO2↑
C.钠投入水中:Na+2H2O==Na++2OH—+H2↑
D.碳酸氢钠溶液与硫酸混合:HCO3—+H+=H2O+CO2↑
5.按 Na、K、Rb、Cs 四种金属顺序减弱或减小的性质是( )
A.还原性 B.密度 C.原子半径 D. 熔点
6.某元素二价阴离子的核外有18个电子,质量数为34,该元素原子的原子核中的中子数为 ( )
A.18 B.16 C.14 D.12
7.同温同压下,下列气体各11.2 L,质量最大的是( )
A.NH3 B.CH4 C.SO2 D.H2S
8.下列溶液中的氯离子浓度与50 ml 1 mol/L FeCl3溶液中氯离子浓度相等的是( )
A. 150 ml 1 mol/L的NaCl溶液 B. 75ml 2 mol/L的NH4Cl溶液
C. 150 ml 3 mol/L的CuCl2溶液 D. 75ml 1 mol/L的AlCl3溶液
9.具有下列结构的原子一定属于碱金属的是 ( )
A. 最外层电子数为次外层电子数的一半 B. 最外层上只有一个电子
C. M层电子数为K层电子数的1/2 D. 最外层电子数是电子层数3倍
10.元素周期表里金属元素和非金属元素分界线附近能找到 ( )
A. 新制农药的元素 B.制半导体的元素
C.制催化剂的元素 D.制耐高温、耐腐蚀的合金的元素
11.下列说法正确的是 ( )(NA表示阿佛加德罗常数)
A.1.2g金属镁变为镁离子时,失去电子数目为0.1 NA
B.标准状况下,11.2 L 氖气含有的原子数为 NA
C.25℃,101KPa下,11.2 L 氧气含有的原子数为 NA
D.标准状况下,11.2 L水含有的分子数为0.5 NA
12.科学家对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质,将它命名为“类铅”。以下对“类铅”的叙述正确的是 ( )
A.最外层有6个电子 B.是非金属
C.主要化合价为+3,+4价 D.最高价氧化物有较强氧化性
13.下列分子所有原子最外层电子数都满足8电子结构的是( )
A.三氯化铋(BiCl3) B.五氯化磷 C.三氟化硼(BF3) D.二氟化氙(XeF2)
14.已知碳有两种常见同位素![]() C与
C与![]() C,氧有三种同位素
C,氧有三种同位素![]() O、
O、![]() O、
O、![]() O,由碳和氧两元素构成的氧化物分子有( )
O,由碳和氧两元素构成的氧化物分子有( )
A.6种 B.12种 C.18种 D.24种
15.两种短周期元素组成的化合物中原子数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能为 ( )
① a==b+5;②a+b==8;③a+b==30;④a==b+8
A.②③ B.①②④ C. ②③④ D.①②③④
16. 某KOH溶液,蒸发掉63 g水后,溶质质量分数恰好增大一倍,体积变为500 mL,则浓缩后溶液的物质的量浓度可能为 ( )
A.4 mol/L B.3 mol/L C.2.5 mol/L D. 0.63 mol/L
第Ⅱ卷(非选择题,共52分)
二、填空题(共41分)
(2分)17.充分加热碳酸钠和碳酸氢钠混合粉末,产生的气体分别通过足量的Na2O2、浓硫酸,最终得到的气体是_____(用化学式填写),其电子式为_________。
(4分)18.在![]() H,
H,![]() H,
H,![]() H,
H, ![]() Mg,
Mg,![]() Mg,
Mg,![]() O,
O,![]() O,
O,![]() O中共有_______种元素,______种原子,中子数最多的是__________。D218O的相对分子质量为_________。
O中共有_______种元素,______种原子,中子数最多的是__________。D218O的相对分子质量为_________。
(4分)19.实验室制取有毒的氯气时,常用氢氧化钠溶液来吸收多余的氯气,其反应的化学方程式为:Cl2+2NaOH==NaCl+NaClO(次氯酸钠)+H2O。写出其离子方程式______________________,并在化学方程式上用“双桥法”标出电子转移的方向和数目。
(15分)20.(1)8 g某物质含有3.01×1022个分子,该物质的相对分子质量为 。(2)标准状况下,1.12 L氯化氢气体溶于水中配成250 mL溶液,此溶液中盐酸的物质的量浓度为 ,取出10mL此溶液,其中含氯化氢的质量为 。(3)3.2 g XO2中含有0.1 mol的氧原子,则X的摩尔质量为 。(4)V L Al2(SO4)3溶液中含有A g Al3+ 离子,则此溶液中SO42—的物质的量浓度是 _______________。
(9分)21.标准状况下,a L HCl气体溶于10 g水中,得到的盐酸的密度为b g·cm—3,则该盐酸的物质的量浓度为____________________ mol/L;溶质质量分数为c%,密度为d g/cm3的硫酸溶液V mL加水稀释到5 V mL,所得溶液的物质的量浓度为_______________ mol/L;相对分子质量为A的某物质在室温下的溶解度为B g,此饱和溶液物质的量浓度为D mol/L,则该饱和溶液密度为________________ g/cm3。
(4分)22. 已知:Na2O+CO2==Na2CO3,根据同主族元素性质相似,完成下列反应的化学方程式: Na2S+ As2S5==________________。欧洲核子研究中心于1995年9至10月间制成了世界上第一批反原子——共9个反氢原子,揭开了人类制取、利用反物质的新篇章。请用离子方程式表示出反物质酸碱中和反应的实质________________________。
(3分)23.用1000 g溶剂中所含溶质的物质的量来表示溶液的浓度叫做质量物质的量浓度,其单位是mol/Kg。10 mol/Kg的硫酸的密度是d g/cm3,则其物质的量浓度为 ________________mol/L。
三、实验题(共11分)
(6分)24.配制250 mL 0.2 mol/L的KCl溶液时,需要用天平称量_____g KCl。所需仪器有托盘天平、量筒、烧杯、玻璃棒、 、 。并分析下列操作可能导致的最终溶液的物质的量浓度误差:(填“偏大”、“偏小”、“无影响”)
(1)移液时容量瓶尚未干燥 ;(2)定容时俯视 ;(3)定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线 。
(5分)25.现用CO2气体和NaOH固体制取较纯的Na2CO3固体。简述操作过程。
要求:①不能用NaHCO3受热分解;②方法要最简单;③由于Na2CO3固体要“较纯”,必须考虑反应物的用量。
第Ⅱ卷(非选择题,共52分)试卷答题纸
二、填空题(共41分):
17.(2分) 化学式____________,电子式___________。
18.(4分)____种;______种;______;_______。
19.(4分)_____________________________;_________________________________。
20.(15分)__________,___________,__________,____________,____________。
21.(9分)___________________mol/L;___________________mol/L;_______________g/cm3。
22.(4分)Na2S+As2S5==________________。________________________。
23.(3分)________________mol/L。
三.实验题(共11分):
24.(6分)________g。_________、____________。
(1)________;(2)_________;(3)_________。
25.(5分)
附加题(20分)
1.写出下列反应的离子方程式。
(1)硫酸铝溶液与碳酸钠溶液混合_____________________________________
(2)氯化铝溶液与偏铝酸钠溶液(NaAlO2)混合_______________________________
(3)氯化铁溶液与次氯酸钠溶液混合____________________________________
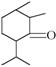 2.写出下列有机物的分子式。
2.写出下列有机物的分子式。
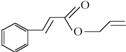
![]()
_________; ____________; _________。
3.分子式为C8H8的有机物已经发现的同分异构体有立方烷,苯乙烯,环辛四烯。试写出可能的其它同分异构体5种(用键线式表其结构)
①_____________②______________③_________________④_____________⑤___________
4.在一定的温度下,用X射线衍射法测得干冰晶胞边长为5.72×1O—8cm,求该温度下干冰的密度。
参考答案
一、选择题
1.C 2.A 3.B 4.D 5.D 6.A 7.C 8.D 9.C 10.B 11.A 12.D
13.A 14.C 15.D 16.D
二、![]()
![]() 填空题
填空题
![]()
![]()
![]()
![]() 17、 O2
O O
17、 O2
O O
18、3、8、2412Mg 、22。
19.Cl2+2OH—==Cl—+ClO—+H2O、略。
20、160、0.2mol/L、0.073g、32g/mol、(A/18V) mol/L。
21、1000ab/(36.5a+224)、dc/49、AD(100+B)/1000B。
22、3Na2S+As2S5==2Na2AsO4。H—+OH+==H2O。
23、1000d/198
三、实验题
24、3.7、250mL容量瓶、胶头滴管。
(1)无影响;(2)偏大;(3)偏小。
25、将氢氧化钠溶于适量蒸馏水中制成溶液。用一半氢氧化钠溶液吸收过量CO2气体至CO2气体不再溶解;小心煮沸溶液1至2分钟,在所得到的溶液中加入另一半氢氧化钠溶液,充分混合后,将溶液蒸干即得较纯的氢氧化钠溶液。