高一化学上学期期末考试题
共150分。考试时间120分钟。
第Ⅰ卷(共67分)
| 第Ⅰ卷所考查的内容都是同学们所熟悉的知识,请大家沉着地分析和应答,相信自己的实力! |
相对原子质量:H—1;C—12; N—14;O—16;S—32;Cl—35.5;Ca-40; Fe—56;
Cu—64;Zn—65
一、选择题(本题共5小题。每小题3分共15分,只有一个选顶符合题意。)
1.化学不仅在书本里,化学还在生活中。比如厨房里常用小苏打或泡打粉去除砧板的鱼腥味,而残留的小苏打或泡打粉异味则应用下列物品去除( )
A.食盐 B.石灰 C.陈醋 D.草木灰
2.宣传科学知识,揭露伪科学是科学工作者和青少年学生的权利和义务。下列各种说法中在科学性上没有错误的是( )
A. 用特殊的催化剂可将水变成石油
B.溴化银可用于人工降雨
C.这种饮料不含任何化学物质,绝对纯净
D.煤的气化和液化是高效、清洁地利用煤炭的重要途径
3.理科学科中物理量的学习是一个很重要的环节。在等温等压条件下,下列各物理量中,因水的量的改变而改变的是( )
A.水的密度 B.电解水时转移的电子数 C.水的沸点 D.水的摩尔质量
4.结构决定性质。请运用这个规律分析判断下列有关氯原子和氯离子说法中正确的是( )
A.都易与钠原子反应生成氯化钠 B.都能稳定存在于自然界中
C.元素种类相同 D.氯原子有颜色,氯离子没有颜色
5.类推的思维方式在化学学习与研究中有时会产生错误的结论,因此,类推出的结论最终要经过实践的验证才能决定其正确与否。以下类推的结论正确的是( )
A.Na、Al具有强还原性,Na常温下与水剧烈反应,故Al也是
B.Na2O2和H2O2都是过氧化物,Na2O2是制氧剂,所以H2O2也是
C.标准状况时,1molCl2的体积约为22.4L。故Br2也是
D.由2Fe+3Cl2 == 2FeCl3可推出2Fe+3I2 == 2FeI3成立
二、选择题(本题共13小题,每小题4分共52分。每小题有一个或两个选顶符合题意。)
6.生活用食盐必须是国家统一标准的“碘盐”。下列关于“碘盐”的叙述中正确的是( )
A.“碘盐”就是“I2+ NaCl” B.“碘盐”就是食盐中加入适量的KIO3
C.“碘盐”就是NaI D.“碘盐”中含碘越多越好
7.能量无时无刻不伴随着我们,化学中也是。下列有关能量的说法中正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生放热反应
C.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
D.木炭在氧气中的燃烧是吸热反应
8.一定条件下KClO3与I2可发生下列反应:2KClO3+I2=2KIO3+Cl2,结合所学的知识来推断下列相应的结论中不正确的是( )
A.反应中氧化剂是KClO3 B.单质的还原性:I2> Cl2
C.元素的非金属性:I>Cl D.KClO3在反应中得电子
9.设NA表示阿伏加德罗常数。下列说法中正确的是( )
A.18克H2O中所含的电子总数为10 NA
B.常温常压下,28g氮气所含有的原子总数为NA
C.标准状况下任何气体的体积都约为22.4L
D.常温下,0.5mol·L-1的NaCl溶液中Na+的浓度为0.5mol·L-1
10.下列各组离子在溶液中,因发生离子间氧化还原反应而不能共存的是( )
A.Na+、Ba2+、Cl-、SO42- B.K+、ClO-、NO3-、H+
C.H+、Na+、Cu2+、OH- D.H+、Cl-、Fe2+、NO3-
11.MnO2和浓盐酸反应制取氯气时,当有4mol HCl被氧化时,下列说法正确的是 ( )
A.反应中消耗了8mol HCl B.生成了标准状况下的气体44.8L
C.生成了标准状况下的气体89.6L D.氯化氢是氧化剂
12.用托盘天平称取5.3gNa2CO3固体有如下几步操作:①将游码拨至0.3处;②将游码拨至“0”处;③在天平的两边托盘上各放一张干净等质量的滤纸;④取起药品,将砝码放回盒内;⑤往左盘上逐步添加Na2CO3直至天平平衡;⑥在右盘上放置5g砝码。则正确的操作顺序是( )
A.②③⑥①⑤④② B.②⑥①③⑤④②
C.①②③⑤⑥④② D.②④⑤①⑥③②[答案:A ] [解析: ]
13.书写离子方程式时要注意一些细节。比如某物质是不是难溶等等。请运用您所掌握的知识来判断下列离子方程式的书写中正确的有( )
A.NaHCO3 溶液与盐酸反应 HCO3-+ H+ = H2O + CO2↑
B.CuO与H2SO4混合
Cu2+ + SO42-= CuSO4
C.用NaOH溶液吸收少量CO2 CO2
+ 2OH-= H2O + CO32-
D.Na与水反应 Na + 2H2O = Na++2OH-+H2↑
14.用漂白粉溶液浸泡过的有色布条,如凉置在空气中,过一段时间,其漂白效果更好的原因是( )
A.漂白粉被氧化了 B.有色布条被空气中的氧气氧化了
C.漂白粉分解了 D.漂白粉和空气中的CO2充分反应生成了HClO
15.配制一定物质的量浓度的溶液,是中学必须掌握的基本实验操作。现使用胆矾(CuSO4·5H2O)配置0.1mol·L-1的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水里
B.称取胆矾5g,溶解在1L水里
C.将25g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g胆矾溶于水,然后将此溶液稀释至1 L
16.常温下,取下列固体各10g,分别与90g水充分混合,所得溶液中溶质的质量分数最小的是( )
A.Na2O B.CaO C.SO3 D.CuSO4·5H2O
17.有五瓶溶液分别是:①10mL0.60mol·L-1NaOH溶液,②20mL0.50mol·L-1H2SO4水溶液,③30mL0.40mol·L-1HCl水溶液,④40mL0.30mol L-1NaCl水溶液,⑤50mL0.20mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
18.在t℃时,NaCl的溶解度是36 g,t ℃时将80NaCl放入200g水中充分搅拌后,得到密度为1.12g·cm3的溶液,则该溶液的物质的量浓度为( )
A.0.15 mol·L-1 B.1.36 mol·L-1
C.5.07 mol·L-1 D.6.15mol·L-1
第Ⅱ卷 (非选择题 共83分)
| 第Ⅱ卷所考查的是同学们对所学知识的综合应用能力,注意试题的明显信息,沉着地分析和应答,相信自己有实力完成大多数的题目! |
三、(本题包括3小题,共26分)
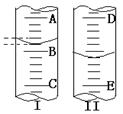 19.(4分)(1)图I表示10 mL量筒中液面的位置,A与 B,B与C刻度间相差1 mL,如果刻度A为5,量筒中液体的体积是_______mL
19.(4分)(1)图I表示10 mL量筒中液面的位置,A与 B,B与C刻度间相差1 mL,如果刻度A为5,量筒中液体的体积是_______mL
(2)图II表示25 mL滴定管中液面的位置 ,如果液面处的读数是a,则滴定管中液体的体积(填代号)________。
A.是a mL B.是 (25 – a) mL
C.一定大于a mL D.一定大于 (25 - a)mL
[答案:(1)3.2 (2) D ] [解析:]
20.(10分)有1支干燥的小试管中,装有少量白色物质(约占试管容积的1/10),已知该白色物质肯定是碳酸氢钠、碳酸钠或氯化钠中的一种,现通过加热试管中样品和使用蒸馏水、石蕊试液或稀盐酸进行鉴定。
(1)该实验的步骤与内容(略)
(2)请思考并填写下表:
| 白色物质 | 判断依据 | 1个有关化学方程式(或离子方程式) |
| 碳酸氢钠 | ||
| 碳酸钠 | ||
| 氯化钠 |
|
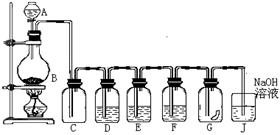 21.(12分)实验室用下列装置制取氯气,并进行后面的实验,请回答下列问题:
21.(12分)实验室用下列装置制取氯气,并进行后面的实验,请回答下列问题:
(1)A、B中各装什么物质?
A:_____________
浓盐酸B:_____________二氧化锰
A与B反应的离子方程式为:________________________________________
(2)储气瓶C中的现象是:___________________________________________有黄绿色气体出现
(3)D是为了除Cl2中的HCl气体,D中应放入下列溶液中的______D。(填序号)
A、NaOH溶液 B、Na2CO3溶液 C、AgNO3溶液 D、饱和食盐水
(4)E装置是为了干燥氯气,装置中应放入下列物质中的______。(填序号)C
A、NaOH溶液 B、碱石灰 C、浓硫酸 D、饱和食盐水
(5)F中放入KI淀粉溶液,观察到的现象是__________________________。
原因是___________________________________________________________。红色退去;Cl2遇潮湿的物质后有HClO生成,HClO有漂白作用
(6)G装置中是湿润的红色布条,观察到的现象时_____________________。
原因是___________________________________________________________。溶液由无色变为蓝色,氯气与KI反应生成I2,生成的碘使淀粉变蓝
(7)J装置中放入NaOH溶液的作用是_______________________________。
[答案]: 吸收多余的氯气(没空1分,方程式2分) [解析]:
四.(本题含3小题,共38分)
22.(8分)长期以来,人们一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO以来,对HFO的研究引起了充分重视。:
(1)HFO的化学名称为_______________。次氟酸
(2)HFO能与水发生反应:HFO+H2O=HF+H2O2,其中氧化剂是_____HFO_。
(3)写出F2与水发生反应的化学方程式,并用双线桥法标出该反应的电子转移的方向和数目_____________________________________________。
[答案]: [解析]:
23.(12分)(1)氧化还原反应的本质是_________________,在氧化还原反应中,氧化剂_____电子,本身发生______反应。在2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O反应中,若消耗1mol氧化剂,则被氧化的还原剂的物质的量是___5(3分)____mol。
(2)在9.5g某二价金属的氯化物中含有0.2mol Cl-,此氯化物的摩尔质量是___________。该金属的相对原子质量为_____________。
 24.(18分)根据下图所示的转化顺序及实验现象推断A→X个是什么物质?已知:B为黑色粉末,C、F、X为单质,其它为化合物(A、B反应的其它产物略)。
24.(18分)根据下图所示的转化顺序及实验现象推断A→X个是什么物质?已知:B为黑色粉末,C、F、X为单质,其它为化合物(A、B反应的其它产物略)。
(1)A __________;B __________;C __________;D __________;E __________;
F______ ____;G __________;X __________。
(2)写出C和D溶液反应的离子方程式______________________________。
五.(本题含2小题,共19分)
25.(9分)标准状况下,用一定量的水吸收氯化氢气体后制得浓度为12. 0 mol·L-1、密度为1.20g·cm-3的盐酸。试计算1体积水吸收多少体积的氯化氢气体可制得上述盐酸(本题中氯化氢的式量以36.5计,水的密度以1.00g·cm-3计)。
[答案]: 2.5d mol/L [解析]:
26.(10分)在500 mL 0.1mol·L-1的硫酸溶液中投入铁锌混合物2.33 g,充分反应后,铁锌全部溶解,放出气体0.896L(标准状况),求:
(1)原混合物中铁与锌的物质的量分别是多少?
(2)设反应后溶液体积仍为500 mL,求反应后溶液中SO42-的物质的量浓度。
高一化学上学期期末考试题
参考答案
(1~5每题3分,6~18每题4分共67分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | B | C | B | B | AB | C | AD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | AB | A | AC | D | C | B | D | C |
三、(本题包括3小题,共26分)
19.(4分)(1)4.2(2分) (2)D(2分)
20.(10分)填表:(其他合理答案酌情给分,次序有误扣1分)
| 白色物质 | 判断依据 | 1个有关化学方程式(或离子方程式) |
| 碳酸氢钠 | 加热产生的气体能使润湿石蕊试纸变红 | 分解方程式或CO2与水作用显酸性方程式 |
| 碳酸钠 | 加热不分解,与稀盐酸反应产生气体 | 与稀盐酸反应方程式 |
| 氯化钠 | 加热不分解,不与稀盐酸反应 |
|
21.(12分)(1)A:浓HCl B:MnO2 方程:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
(2)有黄绿色气体生成(3)D (4)C (5)溶液变兰。因为Cl2置换出I2,遇淀粉变兰。
(6)红色褪去。因为湿的氯气有漂白性。(7)吸引多余的Cl2。
四.(本题含3小题,共38分)
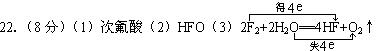
23.(12分)(1)有电子发生转移;得;还原;5。(2)95g/mol;24。
24.(18分)(1)A:浓HCl B:MnO2 C:Cl2 D:KBr E:KCl F:Br2 G:NaI X:I2
(2)Cl2+2Br—=Br2+2Cl—
五.(本题含2小题,共19分)
26.(9分)1.00L该盐酸中含HCl的质量为:12.0mol×36.5g·mol-1(1分)
其体积在标准状况下为:12.0mol×22.4L·mol-1(1分)
1.00L该盐酸中含水的质量为:1.00L×1.20g·L-1-12.0mol×36.5g·mol-1(1分)
其体积为:[1.00L×1200g·L-1-12.0mol×36.5g·mol-1]/1000g·L-1(2分)
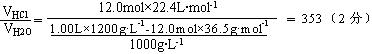
1体积水吸收353体积HCl气(标准状况)。(2分)
若直接列出总式,同样给分。
27.(10分)(1)设原混合物中铁和锌的物质的量分别为Xmol、Ymol。根据反应及题意知:
Fe+H2SO4=FeSO4+H2 Zn+H2SO4=ZnSO4+H2
1 1 1 1
Xmol Xmol Ymol Ymol——————2分
![]() 知 : 22.4(X+Y)=0.896
知 : 22.4(X+Y)=0.896
56X+65Y=2.33 ————————2分
得:X=0.03 Y=0.01 ————————2分
所以混合物中Fe、Zn的物质的量分别为0.03mol、0.01mol.——1分
(2)根据反应实质可知,硫酸根不参与反应。所硫酸根的浓度不变。即:
C=0.1mol·L-1。——————3分