高一化学上学期期末练习
说明:1.本练习满分为100分,共五道大题。
2.请将选择题答案答在答题卡上;其他答案答在题目空白处。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55 Ag 108
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意。)
1.医生建议甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的
A.钾元素 B.铁元素 C.碘元素 D.锌元素
2.“服用维生素C可使食物中的三价铁离子变成二价铁离子”这句话说明
A.维生素C本身被还原 B.维生素C具有还原性
C.维生素C具有氧化性 D.维生素C发生了还原反应
3. 下列两种气体在常温下混合就能发生爆炸的是( )
A.H2和O2 B. H2和F2 C. H2和Cl2 D.CH4和O2
4.下列物质中分子数最多的是( )
A.64g SO2 B.3.01×1023个N2分子
C.0.75mol H2SO4 D.标准状况下33.6L Cl2
5. 下列物质在空气中放置一段时间后不会明显变质的是
A. 食盐水 B. 漂白粉 C. 烧碱溶液 D.氯水
6.下列关于能量转换的认识中不正确的是
A.绿色植物光合作用过程中太阳能转变成化学能
B.煤燃烧时化学能主要转变成热能
C.电解水生成氢气和氧气时,电能转变成化学能
D.白炽灯工作时电能全部转变成光能
7.不能使橙黄色溴水变为无色溶液的是
A.KOH溶液 B.镁粉 C.CCl4 D.KI溶液
8.有关卤素的说法正确的是
A.卤离子的还原性随核电荷数的增加逐渐减弱
B.卤素单质的熔点随相对分子质量的增大而升高.
C.卤素是典型的非金属元素其单质只具有氧化性
D. 卤离子的半径比其对应的原子半径小
9.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入绿豆大小的金属钠,观察到的现象可能是
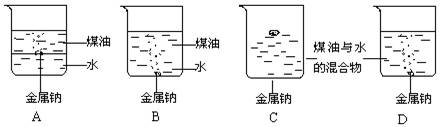
10.十八世纪70年代,瑞典化学家舍勒在研究一种白色的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑,并有刺激性气味,此盐是
A. Na2SO4 B.AgCl C.Na2CO3 D.AgI.
11.用天平称量 4.0 g NaOH固体,并将固体放入烧杯中,用适量的蒸馏水溶解后,冷却至室温。将烧杯中溶液沿玻璃棒小心地注入 100 mL容量瓶中,并多次洗涤烧杯、振荡溶液、加蒸馏水并定容(用胶头滴管加蒸馏水至刻度线);将所得溶液分装在5个干燥、洁净的细口瓶中,在细口瓶上所贴标签应注明
A. 20.0 mL 0.1 mol/L NaOH溶液 B. 1.0 mol/L NaOH溶液
C. 0.1 mol/L NaOH溶液 D. 100.0 mL 1.0 mol/L NaOH溶液
12.下列反应中,Na2O2只表现强氧化性的是
A.2Na2O2+H2SO4=2Na2SO4+2H2O+O2↑
B.Na2O2+MnO2=Na2MnO4
C.2Na2O2+2H2O=4NaOH+O2↑
D.5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+5O2↑+ 8H2O
13.下列实验中,反应后溶液中H+的物质的量浓度明显增大的是
A.金属钠放入水中 B.将CO2通入饱和CaCl2溶液中
C.将氯水久置 D.将NaOH溶液加入到溴水中
14. 在下列各说法中都包含有前后两个数值,其中前者小于后者的是
A. 相同压强时,F2 与 Cl2 的沸点 B. 相同条件下,Br2 与I2 在水中的溶解度
C.Cl2 与HCl的摩尔质量 D. 金属锂与金属铷的熔点
15.将一定量的Na2CO3·10H2O与NaHCO3的混合物完全溶解于水,配成100 mL溶液,测得溶液中Na+的浓度为0.4 mol/L,若将溶液蒸干并灼烧到质量不变,可得到固体的质量是
A.2.12 g B.1.68 g C.0.92 g D.2.55 g
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。)
16.用NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 2 g H2 与适量Cl2在光照时恰好反应,生成的HCl分子数目为NA.
B.0.1 mol Na2SO4 溶于水,溶液中Na+ 数目为0.2NA
C.标准状况下,22.4 L Cl2 与足量的 NaOH溶液反应时,电子转移数目为NA
D. 0.1 mol Na2O 溶于水时,溶液中O2- 数目为0.1NA.
17. 鉴别卤素离子(Cl-,Br-,I-)可以用的试剂为
A. 硝酸银溶液,稀硝酸 B. 碘水,淀粉溶液
C. 氯水,四氯化碳 D. 淀粉碘化钾溶液
18.某无色透明的溶液能与铁粉反应放出H2,则此溶液中可能存在的离子组是
A. OH-,Ba2+,Cl-,Na+ B. H+,I-,Na+,Br-
C .H+,Cl-,Na+,SO42- D. H+,Cu2+,Cl-,SO42-
19.将钠和碳分别置于如图所示的两个盛满氧气的集气瓶中点燃,充分燃烧后冷却至室温;在同时打开装置中的两个活塞,将观察到
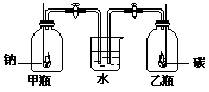
A.水不进入任何一瓶 B. 水迅速进入甲瓶而不进入乙瓶
C. 水迅速进入乙瓶儿不进入甲瓶 D.水同时进入两瓶
20. Z是X、Y两种金属的混合物,当X、Y、Z分别与足量盐酸反应时产生氢气的量如图所示,其中横坐标表示消耗金属的物质的量(mol),纵坐标表示产生氢气的体积(L,标准状况),下列有关 Z 的组成判断正确的是
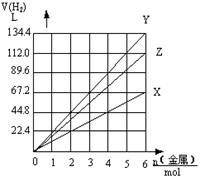
A. n(Mg)∶n(K) = 1∶2 B. n(Na)∶n(Zn) = 2∶1
C. n(Fe)∶n(Zn) = 1∶1 D. n(Na)∶n(Fe) = 1∶2
三、填空题(22分)
21.(16分) 常温下,A是含元素 X 的气态单质,其密度为 3.17g/L(标准标况下),B、C、D、E 都是含元素X的化合物,其转化关系如右图所示。
(1)请分别写出A、B、C、D 的化学式(如为溶液请填溶质的化学式):
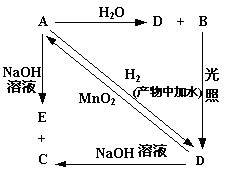
A 、 B 、C 、 D ;
(2)在通常情况下,A 的物理性质是(就你所知,尽可能多写) ;
(3)写出下列反应的化学方程式或离子方程式(请注明条件):
A + H2O(离子方程式) ;
A→D(化学方程式) ;
D→C(离子方程式) ;
A + NaOH (离子方程式) ;
D→A(化学方程式) 。
22.(6分)如将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去,产生该现象的原因可能有两个:
①是由于 (简要文字说明)
②是由于 (简要文字说明)
简述怎样用实验证明红色褪去的原因是①或者是② 。
四、实验题(共29分)
23.(7分)(1)现有 100 mL、250 mL、500 mL 和 1000 mL 四种规格的容量瓶,某实验需用约 400 mL 0.10 mol/L 的氯化钠溶液,应选用 的容量瓶配制溶液;
(2)配制溶液时需要用到的实验用品还有(填名称) ;
(3)配制 0.10 mol/L 的氯化钠溶液时,下列操作顺序正确的是(填写选项字母) ;
①轻轻振荡容量瓶,使溶液充分混合
②用天平称量纯净的氯化钠固体 2.9 g ;
③将烧杯中的溶液沿玻璃棒小心地注入容量瓶中
④将容量瓶用瓶塞盖好,反复上下颠倒、摇匀
⑤将配制好的溶液倒入干燥、洁净的试剂瓶中,贴好标签备用
⑥将称量好的氯化钠固体放入烧杯中,加入适量的蒸馏水使固体完全溶解
⑦用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切
⑧用蒸馏水洗涤烧杯内壁 2~3 次,将每次洗涤后的溶液也都注入容量瓶中
⑨向容量瓶中注入蒸馏水,直到容量瓶中的液面接近容量瓶刻度 1 cm ~ 2 cm 处
A. ②③①④⑥⑦⑧⑨⑤ B. ②③①⑥⑦⑧⑨④⑤
C. ②⑥③⑧①⑨⑦④⑤ D. ②⑦③④①⑦⑧⑨⑤
24.(16分)已知无水硫酸铜(CuSO4)是一种白色粉末状固体,遇水可化合生成五水合硫酸铜(CuSO4·5H2O)为蓝色晶体,利用此反应可检验水的存在。现欲用实验方法证明新制备的氯水中有Cl2、H2O、HClO、HCl等物质的存在。
(1)检验Cl2的存在用______试纸,其现象是________,化学方程式为_____________;
(2)检验H2O的存在,用的试剂为_______,其现象是________,化学方程式为_____________;
(3)检验HClO存在,用_________________,其现象是__________________________;
(4)检验HCl的存在,先检验 H+ 存在,所用的试剂为______,其现象是__________;再检验Cl- 的存在,所用试剂为____________,其现象为_________,化学方程式是_________。
25.(6分)下面是关于药物华素片(西地碘片)使用说明中的部分内容:
| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在凉处保存。 [有效期]二年 |
(1)请根据这段文字判断,华素片中含有的活性成分是 (写分子式);
(2)某同学欲证实华素片中确实含有上述成分,设计并完成了如下实验:
①取出一粒药片,认真观察其外观;
②将该药片放入研钵中研碎后,分装在二个小试管中并分别加入约2 mL蒸馏水,振荡后备用;
③向其中一支试管中加入几滴淀粉溶液;
④向另一支试管中加入约2 mL 四氯化碳后用力振荡;
回答下列问题:
(ⅰ)华素片的颜色 (“是”或“不是”)白色;
(ⅱ)描述在实验③中可能观察到的现象 ;
(iii)在右面的图中标示出实验④中所观察到的四氯化碳层及颜色(只选填其中一空)。

五、计算题(9分)
26.用密度为1.19 g/cm3 ,HCl 的质量分数为 36.5% 的浓盐酸跟二氧化锰反应,生成的氯气在标准状况时的体积为 1.12 L。请计算:
(1)浓盐酸中 HCl 的物质的量浓度;
(2)反应耗用的氧化剂的质量。
高一第一学期期末化学练习参考答案
一、选择题 二、选择题(每小题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | B | D | A | D | D | B | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | C | A | A | AD | AC | BC | B | D |
三、填空题(22分)
21.(16分)(1)Cl2;HClO;NaCl;HCl(各1分)
(2)为黄绿色气体,有剧烈的刺激性气味,能溶于水,比空气重,易液化。(写出色、态、味、能溶于水、易液化五点可给满分。如学生还知道氯气的液化温度、成固态时温度、以1∶2的比例溶于水等更详实的内容,可在学习态度、学习的主动性等方面对该生提出表扬。)(2分)
(3)Cl2 + H2O![]() H++Cl-+
HClO;Cl2
+ H2
H++Cl-+
HClO;Cl2
+ H2 ![]() 2HCl(或光照);H+ + OH-
2HCl(或光照);H+ + OH- ![]() H2O
H2O
Cl2 + 2OH- == ClO- + Cl-+
H2O ;MnO2
+ 4HCl(浓)![]() MnCl2
+ 2H2O + Cl2↑(各2分)
MnCl2
+ 2H2O + Cl2↑(各2分)
22.(6分)①氯水中H+与碱中和;②氯水之中HClO具有强氧化性(或漂白性)所致;
向褪色溶液中再滴加NaOH溶液,若红色再现,则是①(H+中和),若红色不再出现,则是② 。(其它合理答案也可给分)(2分)
四、实验题(29分)
23.(7分)(1)500 mL 容量瓶;(1分)(2)烧杯、玻璃棒、胶头滴管、托盘天平、药匙、滤纸、氯化钠、蒸馏水;(2分)(3)C ;(2分)
24.(16分)(方程式2分,其他1分)(1)淀粉碘化钾;变蓝;2KI+Cl2=2KCl+I2
(2)无水硫酸铜;白色粉末变蓝;CuSO4+5H2O=CuSO4·5H2O
(3)湿润的红布;红布褪色(被漂白)
(4)石蕊试液(或金属锌等);由紫色变红色;AgNO3溶液和稀HNO3;产生不溶于稀HNO3的白色沉淀;HCl+AgNO3=AgCl↓+ HNO3
25.(6分)(1)I2 ; (2)(ⅰ)不是;
(ⅱ)试管中物质呈现出特殊的蓝色; (ⅲ)

五、计算题(9分)
26.(1)c(HCl) = 11.9 mol/L (4分) (2)m(MnO2) = 4.35 g(5分)