高一化学暑期专题复习 §1.氧化还原反应
班级 座号 姓名 编辑:张清疆
一、选择题(每题有1—2个正确答案)
( )1.有关氧化还原反应的下列叙述正确的是
A 氧化剂发生还原反应,还原剂发生氧化反应
B 氧化剂被氧化,还原剂被还原
C 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D 氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
( )2.下列化学反应基本类型中一定是氧化还原反就的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
( )3.下列变化需要加入还原剂才能实现的是
A.Na2SO3→ SO2 B.HCl→ Cl2 C.H2SO4(浓) → SO2 D.SO2→ S
( )4.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),
反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
( )5.下列离子,哪种是最强的氧化剂
A Ag+ B Mg2+ C H+ D Cu2+
( )6、下列离子中最易失电子的是
A.Cl— B.Cu2+ C.Fe2+ D.F—
( )7.下列叙述中,正确的是
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定为氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
( )8、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
( )9.根据反应:2A-+C2=2C-+A2 2C-+B2=2B-+C2 2D-+C2=2C-+D2
可以推断反应物D2和B2的关系正确的是
A.B-能被D2置换成B2 B.D-不能被B2氧化
C.氧化性: B2>D2 D.还原性: B->D-
( )10、下列反应中,氧化剂与还原剂的物质的量比为1:2的是
A.Fe+2FeCl3 =3FeCl2 B.3NO2+H2O=2HNO3+NO
C.3C+SiO2 =SiC+2CO D.3S+6KOH =2Na2S+Na2SO3+3H2O
( )11.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,
在反应中被氧化与被还原的氮原子数之比为
A.5∶3 B.5∶4 C.1∶1 D.3∶5
( )12.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A.Cl2+H2O = HCl+HClO B.2Na2O2+2H2O = 4NaOH+O2↑
C.2F2+2H2O = O2+4HF D.2Na+2H2O = 2NaOH+H2↑
( )13.通过以下三个反应事实,确定下列物质中最强的氧化剂是
①Fe+CuCl2 = FeCl2+Cu ②Cl2+2FeCl2 = 2FeCl3
③Cu+2FeCl3 = CuCl2+2FeCl2
A CuCl2 B FeCl2 C FeCl3 D Cl2
( )14. R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n的值是
A.1 B.2 C.3 D.4
( )15.已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。
测得产物中NO2与O2的体积比为6∶1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( )
A.升高 B.降低 C.不变 D.不能确定
( )16.20mL 0.05mol/L含有R2O72-离子的浓溶液恰好能将20mL 0.3mol/L的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
A.+2价 B.+3价 C.+4价 D.+5价
( )17、0.1mol·L-1H2C2O4 40ml恰好将4×10-3mol的VO2—还原,
则在还原产物VO2n—中n的值为 A.5 B.4 C.3 D.2
( )18、将 NO3-+ Zn+ OH-+ H2O→ NH3+ Zn(OH)42- 配平后H2O的系数是
A.2 B.4 C.6 D.8
( )19、M 2Ox2-+3S2-+14H+==2M3++3S+7H2O,M2Ox2-中M化合价是
A.+6 B.+3 C.+2 D.0
( )20、在我国许多地区已发生过误食亚硝酸盐中毒事件。人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐则导致血红蛋白中Fe2+转化为高价铁血红蛋白而中毒。服用维生素C(Vc)可解除亚硝酸盐中毒。以下说法正确的是
A.Vc将Fe3+还原为Fe2+ B.Vc解毒未发生氧化还原反应
C.亚硝酸盐是还原剂 D.Vc是氧化剂
21.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,_________是还原剂,__________是还原产物,_________元素被还原。若有1摩尔HCl参加反应,则有 摩尔电子转移;
若生成1摩尔Cl2,则有 摩尔电子转移。若有73gHCl被氧化,则生成 gCl2
22、标出反应中电子转移情况,并填空。
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;
参加反应的HNO3与被还原的HNO3的质量比为
23.氧化还原反应方程式的配平
1) Zn+ HNO3(稀)—— Zn(NO3)2 + N2O + H2O
2) Fe(NO3)3+ NaOH+ Cl2—— Na2FeO4+ NaNO3+ NaCl+ H2O,
3) KMnO4+ KNO2+ —— Mn SO4+ K2SO4+ KNO3 + H2O
4) MnO4—+ H2O2+ —— Mn2++ H2O+ O2↑
5) KCN+ Cl2+ NaOH—— CO2+ N2+ KCl+ NaCl+ H2O
6) Cu2S+ HNO3—— Cu(NO3)2+ H2SO4+ NO +
7) Fe(OH)3+ ClO-+ = FeO42-+ Cl-+ H2O
8) KI+ KIO3+ H2SO4—— K2SO4+ I2+ H2O
24. KMnO4是常用的氧化剂。在酸性条件下,MnO4-被还原为Mn2+。试写出用KMnO4跟浓盐酸在室温下制氯气的反应的化学方程式
为 。
25.在密闭容器中,将足量溴跟NaOH充分反应,发现低温时只有1/2的溴分子转化为NaBr,而加热时5/6的溴分子转化为NaBr,那么:
低温时反应方程式为 ;
加热时反应方程式为 。
26.(1)在淀粉碘化钾的酸性溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变成蓝色,这是因为(用离子方程式表示) 。
(2)在淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色消失,这是因为 (用离子方程式表示) 。
(3)对比以上两组试验所得结果,将I2、ClO-、SO42-按氧化性由强到弱顺序排列为 。
27.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:
![]()
![]()
![]()
![]()
![]()
![]()
![]() KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
28.用如图所示装置进行实验,将液体A逐滴加入到固体B 中,回答下列问题:
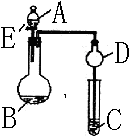 (1)图中D装置在实验中的作用是
.
(1)图中D装置在实验中的作用是
.
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有H2S饱和溶液,
旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,
C中的现象是 ;继续通气体于C 中,
足够长的时间后,发现C中溶液的颜色消失,这 是因为在溶液中I2能被Cl2氧化为HIO3,
写出该反应的化学方程式 。
(4)该题图示装置有多种用途,若要证明SO2的还原性比Br—强,则:
A为 ,B为 ;C中盛 ,
C中现象
答案:
26. 10.(1)2I-+2ClO-+4H+===I2+Cl2+2H2O
(2)I2+SO32-+H2O===SO42-+2H++2I-
(3)ClO-、I2、SO42-
27.(1)2 4 2 2 1 2 H2O (2) ②(3)0.2 (4)2.63
28.(1)防止溶液倒吸 (2)溶液中出现淡黄色浑浊;2H2S+O2=2S↓+2H2O (3)溶液由无色变蓝;5Cl2+I2+6H2O=2HIO3+10HCl
A中盛有浓硫酸、B中盛有Na2SO3、C中盛有溴水溶液;溴水褪色。