第一节 氧族元素•能力达标训练
一、选择题(每小题只有1个选项符合题意)
[ ]1.下列有关氧族元素的说法错误的是
A.原子的电子层结构相似
B.随着核电荷数的增加原子半径增大
C.随着核电荷数的增加金属性增强、非金属性减弱
D.在周期表中位于卤素的右边,比同周期的卤素非金属性弱
[ ]2.氧族元素可形成化合价的情况中正确的是
A.都可形成+6价 B.都可形成+4价
C.都可形成-2价 D.都可形成-2、+4、+6价
[ ]3.下列离子中,半径最大的是
A.S2- B.Te2- C.O2- D.Se2-
[ ]4.不能说明氧族元素非金属性强弱关系的是
A.熔、沸点的高、低,密度的大、小
B.与氢气反应的难、易程度
C.气态氢化物的稳定性
D.最高价氧化物对应水化物的酸性强弱
[ ]5.下列有关臭氧的说法错误的是
A.它与氧气是氧的同素异形体
B.具有强氧化性可做脱色剂、消毒剂
C.可在高压放电条件下由氧气制备
D.臭氧层中含有大量臭氧,可以吸收紫外线,是人类和生物的保护伞
二、选择题(每小题有1或2个选项符合题意)
[ ]6.下列物质不能直接化合得到的是
A.H2O B.H2S C.H2Se D.H2Te
[ ]7.下列反应中正确的是
A.加热条件下:Se+H2=H2Se B.加热条件下:Te+O2=TeO2
C.加热条件下:Cu+S=CuS D.SeO2+H2O=H2SeO4
[ ]8.下列反应中硫表现出还原性的是
A.硫和氢气 B.疏与氧气 C.硫与铁 D.硫与铜
[ ]9.在加热条件下:H2S=S+H2硫元素在此反应中表现为
A.氧化剂 B.还原性 C.氧化反应 D.既被氧化又被还原
[ ]10.下列关于硫和氯两种元素的比较,其中不正确的是
A.硫的原子半径比氯小 B.和氢气化合时,氯气比硫易进行
C.高氯酸酸性比硫酸强 D.氯气可和H2S发生氧化还原反应
[ ]11.1mol铁被氯气氧化比被硫氧化而失去的电子数目
A.相等,都是3×6.02×1023个 B.多2×6.02×1023个
C.少6.02×1023个 D.多6.02×1023个
[ ]12.0.1mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6 g,则该单质可能是
A.钠 B.铁 C.铜 D.铝
三、填空题
1氧族元素位于周期表的 族,族序数=_ 数(原子结构中).
2.硫元素的原子序数为 、位于周期表的第 周期,第 族,硫的原子结构示意图为
3.H2S分子中硫的化合价为________价;它是硫元素形成常见化合价中的________价,在化学反应中此种价态只能________、不能________;对应氧化还原的概念,此种价态只能________、不能________;因此H2S分子通常只有________性.
4.甲、乙2种氧化物里依次含R元素为50%和40%,若已知甲是三原子分子,且与氧的质量比为1∶1,则乙的化学式为________.
四、计算题
1.多少物质的量的KMnO4分解产生的氧气恰好与48g硫粉完全反应.若改用30%的双氧水(密度为1.1g/cm3),需要多少 mL?
2.将各为28 g的铁粉和硫粉在蒸发皿中混合共热,充分反应后求:
(1)生成什么物质?质量是多少g?
(2)反应后蒸发皿中的固体物质是否等于56 g?为什么?
参考答案
一、
1.A,2.C,3.B,4.A,5.D
二、
6.D,7.A、B,8.B,9.B、C,10.A,11.D,12.A、C
三、
1.ⅥA,最外层电子
2.16、3、ⅥA,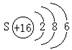 ,电子层
,电子层
3.-2;最低,升高、降低;被氧化、被还原;还原.
4.SO3
四、
1.3mol,309.1mL.
2.(1)硫化亚铁,44g;(2)否,在加热条件下硫粉与空气中的氧气反应,转化为二氧化硫气体,固体质量减少.