第一章 化学反应及其能量变化
提高测试
一、选择题(每小题有1~2个正确答案,每小题3分,共45分)
1.下列叙述中,正确的是( )。
A、含金属元素的离子不一定都是阳离子
B、 在氧化还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、 金属阳离子被还原不一定得到金属单质
2.在一定条件下,硝酸铵受热分解的化学方程式为(未配平):NH4NO3——HNO3+N2+H2O,在此反应中,被氧化与被还原的氮原子之比为( )。
A、5∶3 B、5∶4 C、1∶1 D、3∶5
3.在下列反应中,氨做还原剂的是( )。
A、
|
B、 2NH3+3CuO===3Cu+N2+3H2O
C、2NH3+2Na=2NaNH2+H2
D、 NH3+NaH=NaNH2+H2
4.下列物质中,导电性最差的是( )。
A、熔融氢氧化钠 B、石墨棒 C、盐酸溶液 D、固态氯化钾
5.下列离子方程式中,不正确的是( )。
A、三氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH+4
B、 氢氧化钡溶液和稀硫酸反应:H++OH-=H2O
C、小苏打溶液跟烧碱溶液反应:HCO-3+OH-=H2O+CO32-
D、 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
6.下列各组离子,在强碱性溶液中可以大量共存的是( )。
A、 K+、Na+、HCO3-、Cl- B、Fe3+、Mg2+、SO42-、Cl-
C、NH4+、K+、Cl-、NO3- D、Na+、K+、CO32-、S2-
7.下列各组两种物质在溶液中的反应,可以用同一个离子方程式表示的是( )。
A、Cu(OH)2和盐酸;Cu(OH)2和醋酸(CH3COOH)
B、 BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4
C、NaHCO3和HCl;Na2CO3和HCl
D、 NaHCO3和Ca(OH)2;Ca(HCO3)2和NaOH(过量)
8.以下关于化学反应:KClO3+6HCl=KCl+3Cl2+3H2O电子转移的方向和数目的叙述中,正确的是( )。
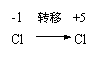 | 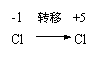 |
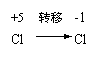
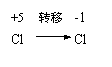 A、由
,共6 e- B、由
,共5 e-
A、由
,共6 e- B、由
,共5 e-
C、由 ,共6 e- D、由 ,共5 e-
|
①4HCl(浓)+MnO2===MnCl2+2H2O+Cl2↑
②4HCl(浓)+MnO2===MnCl2+2H2O+Cl2↑
|
④4HCl + O2====== 2H2O(g)+2Cl2,
则三种氧化剂由强到弱的顺序是( )。
A、O2、MnO2、KMnO4
B、 KMnO4、MnO2、O2
C、MnO2、KMnO4、O2
D、 O2、KMnO4、MnO2
10.下列电离方程式中不正确的是( )。
A、NaOH= Na++ OH-
B、 CH3COOH=CH3COO-+H+
C、NaHCO3=Na++H++CO32-
D、 NaHSO4=Na++H++SO42-
11.对于反应H-+NH3=H2+NH-2的说法正确的是( )。
A、属于置换反应 B、属于氧化还原反应
C、NH3是还原剂 D、氧化产物和还原产物都是H2
12.下列事实中能证明氯化氢是共价化合物的是( )。
A、氯化氢极易溶于水 B、液态氯化氢不导电
C、氯化氢不易分解 D、氯化氢水溶液可以导电
13.下列反应中,属于非氧化还原反应的是( )。
A、 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B、 3Cl2+6KOH=5KCl+KClO3+3H2O
C、 3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O
D、3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
14.在3Cl2+6KOH=KClO3+5KCl+3H2O的反应中,当有m g MgCl2被氧化时,则被还原的Cl2的质量是( )。
A、3 m g B、5 m g C、6 m g D、2.5 m g
二、填空题 (本大题共41分)
15.写出下列物质的电离方程式:①NaHCO3溶于水;②KHSO4熔化;③NH3溶于水;④BaSO4电离。
① _____________;
② _____________;
③ ___________;
④ ____ ________。
16.按要求写出各反应的离子方程式:
①可溶性盐酸盐或盐酸与硝酸银溶液反应 。
②石灰水中加入足量小苏打溶液 。
③二氧化碳通入氢氧化钡溶液 。
17.单质X和Y相互反应生成化合物X2+Y2-。有下列叙述:
①X被氧化;②X是氧化剂;③X具有氧化性;④XY既是氧化产物也是还原产物;⑤XY中的Y2-具有还原性;⑥XY的中X2+具有氧化性;⑦Y的氧化性比XY中的X2+的氧化性强,以上叙述正确的是 。
18.在配平KMnO4、H2O2、H2SO4三者反应的化学方程式时,出现多组配平的化学计量数,如:
①2KMnO4+7H2O2+3H2SO4=K2SO4+2MnSO4+10H2O+6O2↑
②2KMnO4+5H2O2+3H2SO4= K2SO4+2MnSO4+8H2O +5O2↑
③2KMnO4+9H2O2+3H2SO4= K2SO4+2MnSO4+12H2O +7O2↑
用H218O2进行示踪实验,证实生成的氧气全部是18O2,仅根据这一实验事实,回答下列问题:
①H2O2仅起还原作用的化学方程式是 。
②研究三个化学方程式中各组化学计量数的变化规律,写出符合该规律的一个新的化学方程式
。
29.离子Cr2O7X-与S2-能在酸性溶液中发生如下反应:
aCr2O7x-+bS2-+cH+=d Cr3++eS↓fH2O(a、b、c、d、e、f为化学计量数)。若b=3,d=2,则Cr2O7x-中Cr的化合价为 。
20.甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是 。
21.在一定条件下RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O
①RO3n-中R元素的化合价是 __ 。
②R元素的原子最外层电子数是 。
22.按反应式N2H5++4Fe3+→4Fe2++Y+……,在水溶液中,N2H5+将Fe3+还原为Fe2+,作为N2H5+的氧化产物Y可能是 。
三、推断题(本大题共9分)
23.有一种固体物质混合物是由K+、Fe3+、CO32-、SO42-、Ba2+等中的若干种组成,用此物质进行下列实验,现象如下:
①取少量固体放入水中并振荡,固体全部溶解并得到无色溶液A。
②取少量A溶液加入稀硫酸有气泡逸出。
③取少量A溶液加入BaCl2溶液有白色沉淀产生。
根据上述实验现象可知:该固体物质中一定不含有的离子是 ;一定含有的离子是 ;不能证明是否含有的离子是 。
四、计算题(本大题共5分)
24.向氯化钡溶液中加入Na2SO4溶液,直到完全反应为止,结果反应后溶液的质量恰好等于原来氯化钡溶液的质量,求该Na2SO4溶液中溶质的质量分数。
提高测试参考答案
一、选择题(每小题3分,共45分)
1、 AD 2、A 3、B 4、D 5、BD 6、D 7、D
8、B 9、B 10、BC 11、BD 12、B 13、D 14、B
二、填空题(本大题共41分)
![]() 15.(8分)①NaHCO3=Na++HCO3- ;②KHSO4=K++HSO-4 ; ③NH3•H2O NH+4+OH-
;
15.(8分)①NaHCO3=Na++HCO3- ;②KHSO4=K++HSO-4 ; ③NH3•H2O NH+4+OH-
;
④BaSO4=Ba2++SO42-。
16.(6分)①Cl-+Ag+= AgCl↓;②Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
③CO2+2OH-+Ba2+=BaCO3↓+H2O
17.(4分)①④⑤⑥⑦
18.(6分)①2KMnO4+5 H2O2+3H2SO4=K2SO4+2MnSO4+8H2O +5O2↑
②2KMnO4+11 H2O2+3H2SO4= K2SO4+2MnSO4+14H2O +8O2↑
19.(4分)+6价
20.(4分)SiH4(气)+2H2(气)=SiO2(气)+2H2O(气)+1427.6kJ
21.(6分)+5价,7
22.(3分)N2
三、 推断题(9分)
23.Fe3+,Ba2+;CO2-3,K+;SO2-4 .
四 、计算题(5分)
24.60.90%