硫酸●素能培养
一、选择题
1.医疗上作X射线透视肠胃的内服药,俗称“钡餐”的物质是
A.BaCO3 B.BaO C.BaCl2 D.BaSO4
2.将下列物质置于敞口容器中,经过一段时间质量将减小的是
A.浓硫酸 B.氢氧化钠固体 C.浓盐酸 D.生石灰
3.为了除去氢气中含有的少量氯化氢和水蒸气,应选用的装置是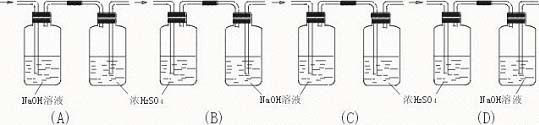
图6—4
4.在足量的饱和CuSO4溶液中,投入1.6 g无水CuSO4,充分搅拌后,析出晶体的质量是
A.等于1.6 g B.大于1.6 g小于2.5 g
C.等于2.5 g D.大于2.5 g
5.下列各组溶液中,可以用来鉴别SO![]() 、SO
、SO![]() 、CO
、CO![]() 和Cl-的最好的一组是
和Cl-的最好的一组是
A.BaCl2、HNO3 B.BaCl2、HCl、Ca(OH)2
C.AgNO3、BaCl2 D.BaCl2、HCl、品红
6.根据某种性质,NaOH(s)、P2O5(s)、CaCl2(无水)可以归为一类。据此,与这些物质不可归为一类的是
A.浓H2SO4 B.NaCl C.碱石灰 D.CaO
7.在下列说法中,错误的是
A.亚硫酸钠溶液与氯化钡溶液相混合,有白色沉淀生成,加稀盐酸后沉淀消失
B.将少量二氧化硫通入氢氧化钡溶液中,有白色沉淀生成
C.将二氧化硫通入氯化钡溶液中,有白色沉淀生成
D.在用硝酸酸化的氯化钡溶液中,加入某溶液,有白色沉淀生成,此现象不足以判
断该溶液中一定存在SO![]() 离子
离子
8.已知HF气体能严重腐蚀玻璃。能在烧瓶中跟过量浓硫酸共热,产生无色而有刺激性气味气体的钠的卤化物是
A.NaF B.NaCl C.NaBr D.NaI
9.17.2 g CaSO4·xH2O转变成2CaSO4·(x-1)H2O时,质量减少2.7 g,则x值是
A.1 B.2 C.4 D.6
10.为方便某些化学计算,有人将98%的浓硫酸表示成下列形式,其中合理的是
A.H2SO4·![]() H2O B.SO3·
H2O B.SO3·![]() H2O C.H2SO4·SO3 D.H2SO4·H2O
H2O C.H2SO4·SO3 D.H2SO4·H2O
|
|
|
C.Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2O
D.2FeO+4H2SO4(浓)====Fe2(SO4)3+SO2↑+4H2O
12.质量为m g的铜与浓H2SO4完全反应,得到标况下SO2气体V L,则被还原的硫酸是
A.![]() mol
B.
mol
B.![]() mol
C.
mol
C.![]() g D.
g D.![]() g
g
13.关于浓H2SO4、稀H2SO4的叙述中正确的是
A.浓H2SO4、稀H2SO4都难挥发
B.浓H2SO4、稀H2SO4都有氧化性,故浓硫酸、稀H2SO4都是氧化性的酸
C.浓H2SO4、稀H2SO4在加热时都能与铜反应
D.浓H2SO4、稀H2SO4在常温下都能用铁制容器贮存
|
2FeSO4=====Fe2O3+SO2↑+SO3↑
如果将生成的气体通入浓BaCl2溶液中,产生的现象是
A.生成BaSO4和BaSO3混合沉淀
B.生成BaSO4沉淀,有SO2气体逸出
C.生成BaSO4沉淀,有SO3气体逸出
D.有SO2和SO3两种气体同时逸出
15.A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D; ③C、E 在冷浓硫酸中发生钝化。由此可判断A、B、C、D、E依次为
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe
D.Mg、Ag、Al、Cu、Fe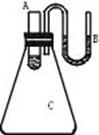
二、填空题
|
(1) ; (2) ; (3) 。
17.欲检验某溶液中含有Cl-、SO![]() 、CO
、CO![]() ,其方法是
。
,其方法是
。
18.Na2SO4溶液,NaCl溶液,NaOH溶液和Na2CO3溶液,这四种溶液都可以与某些物质反应,生成化合物A。
(1)写出A的化学式 。
(2)写出由Na2SO4溶液,NaCl溶液生成A的化学方程式: ,
。
三、计算题
19.有一硫酸和硝酸的混合溶液,取溶液10 mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得到9.32 g沉淀;滤液跟 4 mol·L-1 NaOH 溶液反应,消耗35 mL时恰好中和。求混合溶液中H2SO4和HNO3的物质的量浓度。
20.Na2SO3在空气中极易被氧气所氧化,现有a g样品,将其溶解后,加入足量BaCl2溶液,可得干燥的沉淀bg。
(1)若Na2SO3未被氧化,b= a
(2)若Na2SO3全部被氧化,b= a
(3)若Na2SO3部分被氧化,b相对于a的关系为 。
参 考 答 案
一、1.D 2.C 3.C 4.D 5.D 6.B 7.C 8.B 9.B 10.AB 11.CD 12.AC 13.A 14.B 15.C
二、*16.(1)小试管A内液体分成两层,上层蓝色,下层无色
(2)U形细管内左边液面下降,右边液面上升
(3)小试管A中,两层液体间有少量白色固体析出
17.先加入HNO3,把生成的无色无味气体通入澄清石灰水中,若变浑浊,证明有CO![]() ;然后再在溶液中加入Ba(NO3)2,有白色沉淀生成说明有SO
;然后再在溶液中加入Ba(NO3)2,有白色沉淀生成说明有SO![]() ;最后再加AgNO3溶液,有白色沉淀生成检验出有Cl-。
;最后再加AgNO3溶液,有白色沉淀生成检验出有Cl-。
18.(1)NaNO3
(2)Na2SO4+Ba(NO3)2====BaSO4↓+2NaNO3
NaCl+AgNO3====NaNO3+AgCl↓
三、19.6 mol·L-1
20.(1)b=![]() (2)b=
(2)b=![]() (3)
(3)![]() <b<
<b<![]()