高一化学期中试卷
制卷人:杨小勇 审核人:黄桂香
一、单项选择题(共20分)
1.最近,兰州近代物理研究所研制出我国首批氧-18气体(![]() O2)。
O2)。![]() O称为重氧,下列说法中正确的是
O称为重氧,下列说法中正确的是
A 1.8g氧-18气体的物质的量是0.1 mol B 0.1mol重氧气体的体积是2.24L
C 重氧气体摩尔质量是36g D 0.1mol重氧水所含中子数约是6.02×1023
2.甲乙两种非金属元素①甲比乙容易与氢气化合②甲原子能与乙的阴离子发生氧化还原反应③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应水化物酸性强④与某金属反应时,甲原子得到电子数目比乙的多⑤甲的单质熔沸点比乙的低。能说明甲比乙非金属性强最完整的一组答案是
A ①② B ①②③ C ①②③④ D ①②③④⑤
3.已知A为IIA族元素,B为IIIA族元素它们的原子质数分别为m、n,且A、B为同一周期元素,下列关系肯定错误的是
A n=m+1 B n=m+11 C n=m+25 D n=m+10
4.X、Y、Z是三种主族元素,如果Xm+阴离子与Yn-阴离子具有相同的电子层结构,Zn-阴离子半径大于Yn-阴离子半径,则三种元素原子序数由大到小的顺序是
A Z>X>Y B X>Y>Z C Z>Y>X D X>Z>Y
5.下列微粒半径比大于1的是
A F-/ Mg2+ B Na+/Na C O2-/S2- D Mg2+/Cl-
6.一定物质的量的SO2与NaOH溶液反应,所得溶液中含Na2SO3和NaHSO3,若两者物质的量之比为3:5,则参加反应的SO2和NaOH物质的量之比为
A 3:5 B 1:2 C 18:5 D 8:11
7.某含氧酸的化学式为HnXO2n-1,该含氧酸受热分解生成的氧化物的化学式可能是
A XO B XO2 C X2O3 D XO3
8.硼有两种天然同位素![]() B和
B和![]() B硼元素的相对高质量为10.80,则对硼元素中
B硼元素的相对高质量为10.80,则对硼元素中![]() B的质量分数判断正确的是
B的质量分数判断正确的是
A 20% B小于20% C大于20% D 80%
9. X2、Y、Z2为三种元素的单质,已知有下列反应 Cu+X2=CnX2,2Cu+Y=Cu2Y
2KX+Z2=2KZ+X2在Cu2Y中Y为-2价,下列关于X、Y、Z三种元素的最高价氧化物的水化物的酸性强的顺序正确的是
A HXO4>H2YO4>HZO4 B HZO4>HXO4>H2YO4
C HZO4>H2YO4>HXO4 D H2YO4>HZO4>HXO4
10.Cl2和SO2都可以漂白有色物质,若将等物质的量的Cl2和SO2混合气同时通入滴有紫色石蕊试液的BaCl2溶液中,观察的现象是
A紫色石蕊试液褪色,有白色沉淀生成 B紫色石蕊试液不变色,有沉淀生成
C紫色石蕊试液变红,有沉淀生成 D以上结论都不正确
二、不定项选择题(共24分)
11.FeS2的结构类似于Na2O2是一种过硫化物,与酸反应时生成H2S2,H2S2类似于H2O2分解H2S2=H2S+S↓,实验室制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质为
A H2S B S C FeS D FeCl3
12.设某元素中某原子原子核内的质子数为m,中子数为n,则下列判断正确的是
A不能由此确定该元素相对原子质量 B这种元素的相对原子质量为m+n
C若碳-12的原子质量为Wg,此原子的质量为(m+n)Wg
D核内中子的总质量小于质子总质量
13.运用元素周期律分析下列判断中错误的是
A铍(Be)的氧化物的水化物可能有酸性
B砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸
C硫酸锶(SrSO4)是难溶于水的白色固体
D硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
14.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对较弱是HXO4>H2YO4>H2ZO4,则下列说法正确的是
A气态氢化物的稳定性HX>H2Y>ZH3 B金属性Y<X<Z
C原子半径X>Y>Z
D原子最外电子层上电子数关系Y=![]() (X+Z)
(X+Z)
15.X、Y均为短周期元素,已知aXn-比bYm+多两个电子层,则下列说法中正确的是
A b<5 B X只能位于第三周期 C a+n-b+m=10或16 D Y不可能位于第二周期
16.有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是
A原子层数关系C>B>A B粒子的半径关系Bn->An+
C C一定是稀有气体元素的一种原子 D原子半径的关系是A<C<B
17.FeCl3溶液呈黄色,FeCl2溶液呈浅绿色,向BaCl2溶液中通入SO2气体无现象,但向FeCl3和BaCl2的混合液中通入SO2气体,则出现白色沉淀,过滤得浅绿色溶液,根据该现象,下列说法正确的是
A SO2被氧化,FeCl3被还原 B SO2被还原,FeCl3被氧化
C白色沉淀是BaSO3和S的混合物 D白色沉淀是BaSO4
18.下列说法中错误的是
A Na2SO3与BaCl2溶液作用有白色沉淀生成加HNO3后沉淀消失
B将SO2气体通入Ba(OH)2溶液中有白色沉淀生成
C将SO2气体通入用硝酸酸化的BaCl2中有白色沉淀生成
D将硝酸酸化后的BaCl2试液加入某种溶液中,有白色沉淀生成,不能判断该溶液中一定含有SO42-离子
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||
| 答案 | ||||||||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||
| 答案 | ||||||||||||||||
三、填空题(19题每空1分,其余每空2分,共31分)
19.A、B、C、D四种短周期元素,A、D同族,B、C同族,C、D同周期,A形成的单质是气体中密度最小的气体,B元素的原子最外层电子数是总电子数的![]() ;
;
①写出这四种元素的元素符号A B C D 。
②X和Y都是由这四种元素所形成的化合物,写出X和Y溶液反应的离子反应方程式
。
20.由IIIA族元素A和VIA族元素的B组成的三种阴离子的结构如下图:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() B
X—
Y—
B
B
Z—
B
X—
Y—
B
B
Z—
![]()
![]()
![]()
![]() A—B
B
A—B
B
![]()
![]()
![]()
![]()
![]()
![]()
![]() B
A—B B—A A—B
A A
B
A—B B—A A—B
A A
![]()
![]() A—B B
B
B B
A—B B
B
B B
B 、 、
所带电荷数分别为X= ,Y= ,Z= 。
21.运用物质结构和元素周期律的知识解释下列事实
(1)元素的相对原子质量绝大多数和都不是整数解释为
。
(2)Be(OH)2+2NaOH=Na2BeO2+H2O解释为
。
(3)氟没有正化合价,解释为 。
22.将硫酸在下列反应中所表现的性质,用编号填在横线上。
A酸性 B高沸点酸 C吸水性 D脱水性 E氧化性
①浓硫酸敞口放置质量增加 ②用铝制槽在装浓硫酸
③食盐、二氧化锰、浓硫酸混合共热 ④实验室用硫酸制SO2
⑤实验室用硫酸制氢气 ⑥胆矾放入浓硫酸中变成白色
23.在共价键中,还有一种特殊的共价键,电子对是由一个原子单方面提供跟另一个原子共用的,这样的共价键称为配位键,配位键可以用A→B表示,其中,A是提供电子对的原子。气态氯化铝(Al2Cl6)是含有配位键的化合物,分子中原子间成键的关系如下图所示,请在图中你认为是配位键的斜线上加上箭头。
![]()
![]()
![]()
![]() Cl Cl Cl
Cl Cl Cl
![]()
![]()
![]()
![]() Al Al
Al Al
Cl Cl Cl
四、实验题(每空1分,共13分)
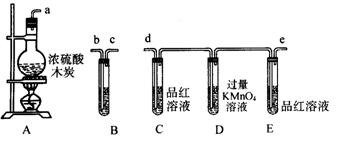 24.为了证实木炭在加热条件下被浓H2SO4氧化生成的产物,选用图示仪器和所盛物质组成的整套装置,并回答下列问题
24.为了证实木炭在加热条件下被浓H2SO4氧化生成的产物,选用图示仪器和所盛物质组成的整套装置,并回答下列问题
①这套装置连接顺序(按气流从左到右填写接上字母) ,说明理由 。
②实验时可观察到试置C中溶液褪色而E中不褪色,这说明 ,试管D中试剂的作用是 。
③要证实反应产物中含CO2,在试管B中装 溶液,有关反应的离子方程式是
。
|
![]()
|
|
![]()
![]()
|
| |||
![]()
|
![]() 洗涤烘干
洗涤烘干
![]()
|
①在用托盘天平称样品时,应先对托盘天平 。
②A的化学式为 ,A必须过量的原因是 。
③确定A是否过量的方法是 。
④白色沉淀b含有 。
⑤无色溶液B通常是 。
⑥通过以上测定可得到样品中杂质的质量分数计算关系式为 。
五、计算题(共12分)
26.接触法制硫酸排放的尾气中,含少量的二氧化硫,为防止污染大气,在排放前进行综合利用(H-1、Na-23、Ca-40、O-16、S-32)
(1)某硫酸每天排放的1×104m3尾气中含0.2%(体积百分数)的SO2,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可以得到多少千克石膏。(CaSO4、2H2O)(2分)
(2)如果将一定体积的尾气通入100mL 2mol/L的NaOH溶液使其完全反应,经测定所含溶质16.7g,试分析溶液组成,并确定各成分的物质的量。(4分)
(3)工厂在尾气处理制石膏过程中,中间产物是亚硫酸氢钠,调节尾气的排放量以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高硫酸氢钠的产量,现设nSO2、nNaOH、nNaHSO3分别代表二氧化硫、氢氧化钠和亚硫酸氧钠的物质的量,且![]() =X,请写出X在不用取值范围时,nNaHSO3的值与nSO2、nNaOH间的关系式。(6分)
=X,请写出X在不用取值范围时,nNaHSO3的值与nSO2、nNaOH间的关系式。(6分)
| X= | nNaHSO3 |
高一化学期中考试答案及评分标准
一、二、选择题(1-10题每题2分,11-18题每题3分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||
| 答案 | D | B | D | A | A | D | B | B | B | C | ||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||
| 答案 | CD | A | D | AD | AC | BC | AD | A | ||||||||
三、填空题(共31分)
19、①A H B O C S D Na (1分×4) ② H++HSO3—=H2O+SO2↑(1分)
20、X=3 Y=2 Z=4 (2分×3)
21、⑴ 元素的相对原子质量是其各种同位素的相对原子质量的平均值,而几乎所有的元素都有同位素。
⑵ Be元素位于周期表中金属与非金属元素的分界线附近(或与Al元素对角线)所以有两性。
⑶ 氟是最活泼的非金属元素 (以上每空2分,共6分)
22、① C E ② B AE ③ A C (以上每空2分,共12分)
![]() 23、
23、![]()
![]()
![]() Cl
Cl Cl (2分)
Cl
Cl Cl (2分)
![]()
![]()
![]()
![]() Al Al
Al Al
Cl Cl Cl
四、实验题(本题每空1分,共13分)
24、① a d e b c 先检验SO2,避免SO=对CO2检验的干扰
② 含SO2,且SO2已被除尽 除去混合气中的SO2
③ 澄清石灰水 Ca2++CO2+2OH—=CaCO3↓+H2O
25、① 调零
② BaCl2 使SO42—离子沉淀完全
③ 静置,取上层清夜再滴加A溶液,看是否有沉淀
④ BaSO4
⑤ 盐酸(答与不答均给分)
⑥ ω杂质=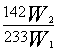 ×100%
×100%
五、计算题(本题共12分)
26、⑴(2分)
解:设理论上可得到石膏的质量为X
根据关系式 SO2————————CaSO4•2H=O
1mol 1mol
![]()
![]()
X=1.54×105g=154Kg
答:理论上可以得到石膏154Kg 。
⑵ 解:nNaOH=100×2×10-3=0.2mol
若 2NaOH + SO2 = Na2SO3 + H2O
0.2mol 0.1mol(12.6g)
若 NaOH + SO2 = NaHSO3
0.2mol 0.2mol(20.8g)
12.6g < 16.7g <20.8g
∴ 该混合物由Na2SO3 和NaHSO3组成
设混合物中含Xmol Na2SO3 ,Ymol NaHSO3
根据题意有:
![]()
![]() 126X+104Y=16.7
X=0.05mol
126X+104Y=16.7
X=0.05mol
2X+Y=0.2 Y=0.1mol
∴ 混合物中含0.05mol Na2SO3 ,0.1mol NaHSO3
⑶
| X= | nNaHSO3 |
| X≥1 | nNaOH |
|
| 2nSO2-nNaOH |
| X≤ | 0 |