高一化学全册综合测试题
一、选择题
1.单质X和Y相互反应生成化合物X2+Y2-。有下列叙述。
①X被氧化 ②X是氧化剂 ③X具有氧化性 ④XY既是氧化产物也是还原产物 ⑤XY中的Y2-具有还原性 ⑥XY中的X2+具有氧化性 ⑦Y的氧化性比XY中的X2+氧化性强
以上叙述正确的是( )
A.①④⑤⑥⑦ B.①③④⑤ C.②④⑤ D.①②⑤⑥⑦
2.已知硫酸铅难溶于水也难溶于酸,却可溶于醋酸铵(NH4Ac,Ac-表示醋酸根离子)溶液形成无色溶液,其化学方程式是:
PbSO4+2NH4Ac![]() Pb(Ac)2+(NH4)2SO4当在Pb(Ac)2)溶液中通入H2S气体时,有黑色沉淀PbS生成。表示这种黑色PbS生成的反应的方程式正确的是( )
Pb(Ac)2+(NH4)2SO4当在Pb(Ac)2)溶液中通入H2S气体时,有黑色沉淀PbS生成。表示这种黑色PbS生成的反应的方程式正确的是( )
A.Pb(Ac)2+H2S![]() PbS↓+2HAc(醋酸)
PbS↓+2HAc(醋酸)
B.Pb2++H2S![]() PbS↓+2H+
PbS↓+2H+
C.Pb2++2Ac-+H2S![]() PbS↓+2HAc
PbS↓+2HAc
D.Pb2++2Ac-+2H++S2-![]() PbS↓+2HAc
PbS↓+2HAc
3.我国三峡工程所提供的清洁、廉价、大功率可再生的水电,相当于每年燃烧3×107吨原煤的火力发电厂产生的电能。因此三峡工程有助于控制( )
A.温室效应 B.氮的氧化物的排放
C.白色污染 D.碳氢化合物的排放
4.下列说法正确的是( )
A.铝片与盐酸的反应是放热反应
B.如果反应物所具有的能量的总和高于生成物所具有的总能量,在发生反应时就会是吸热反应
C.煤的气化和液化是高效、清洁地提高煤的燃烧效率的重要途径
D.人们通常所称的化石燃料一般是指煤、石油和天然气等燃料
5.将一小块金属钠投放盛5mL饱和的澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体产生
C.溶液底部有银白色物质生成 D.溶液变浑浊
6.把2.1g的CO与H2组成的混和气体和足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.1克 B.3.6克 C.7.2克 D.无法确定
7.加热m克质量分数相等的Na2CO3和NaHCO3混合物,一段时间后,质量变为ng,当NaHCO3完全分解时,n值为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
8.铷是一种碱金属元素,对于铷及其化合物性质的推断正确的是( )
①铷的熔点比钾高 ②氯化铷的水溶液pH=7 ③RbOH的碱性比NaOH强 ④铷没有共价化合物 ⑤铷可能从FeCl3溶液中置换出铁
A.②③④ B.①②③④ C.②③④⑤ D.①②③④⑤
9.将5g金属钠与3.2g硫粉迅速混和,并在石棉网上加热,反应后所得固体物质的成分是( )
A.Na2S和Na B.Na2S和S C.Na2S和Na2O2 D.Na2O和S
10.设NA表示阿伏加德罗常数,下列说法不正确的是( )
A.CH3COOH的摩尔质量与NA个CH3COOH分子质量在数值上相等
B.NA个氧分子和NA个氢分子的质量比等于16∶1
C.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
D.17gNH3所含的原子数目为4NA,所含的电子数目为10NA
二、选择题
11.空气和二氧化碳按体积比5∶1混合、将混和气体与足量的红热焦炭充分反应。设空气中N2和O2的体积比为4∶1,不计其他成分,且体积都是在同温同压下测定的,则反应后的气体中CO的体积分数是( )
A.29% B.43% C.50% D.100%
12.将mgCu与足量的浓H2SO4充分反应,得到nL(标准状况)SO2,在反应中被还原的H2SO4的物质的量是( )
A. ![]() mol B.
mol B.
![]() mol C.
mol C. ![]() mol D.
mol D.
![]() mol
mol
13.实验室里需用480mL0.1mol/L的CuSO4溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68gCuSO4、加入500mL水 B.称取12g胆矾,配成500mL溶液
C.称取8.0gCuSO4、加入500mL D.称取12.5g胆矾、配成500mL溶液
14.取A、B、C三种金属各0.1mol,分别与足量的盐酸反应,在标准状况下,共生成6.72LH2,又知B、C所产生的氢气的体积比是2∶1,且两者产生H2的体积之和跟A产生的H2体积相等,则在氯化物中A元素的化合价是( )
A.+1 B.+2 C.+3 D.+4
15.某温度下将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混和溶液,经测定ClO-与ClO3-的浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是( )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
16.关于氯水的叙述,正确的是( )
A.新制的氯水中含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后pH将变小
17.已知CN-(氢氰酸根离子)SCN-(硫氰酸根离子)和Cl-有相似之处:两个-CN原子团或两个-SCN原子团可分别构成氰分子(CN)2和硫氰分子(SCN)2。(CN)2和(SCN)2的性质和Cl2有性质有相似之处,且常温常压下是气体,下列物质间反应的化学方程式错误的是( )
A.二氧化锰和HSCN溶液加热反应:MnO2+4HSCN![]() Mn(SCN)2+(SCN)2+2H2O
Mn(SCN)2+(SCN)2+2H2O
B.(CN)2和氢氧化钾溶液反应:(CN)2+2KOH![]() KCN+KCNO+H2O
KCN+KCNO+H2O
C.碘晶体投入HCN溶液中:I2+2HCN![]() 2HI+(CN)2
2HI+(CN)2
D.(SCN)2和硝酸银溶液反应:
(SCN)2+H2O+AgNO3![]() AgSCN↓+HSCN+HNO3
AgSCN↓+HSCN+HNO3
18.0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素是( )
A.Na B.Mg C.Fe D.Zn
19.浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓) ![]() CaCl2+Cl2↓+H2O
CaCl2+Cl2↓+H2O
用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O(气) ④O2
A.①②③ B.②③④ C.②③ D.①④
20.氯化碘(ICl)的化学性质与Cl2相似,溴化碘(IBr)的化学性质与溴相似,在粗碘中含ICl和IBr,受热时I2、ICl、IBr均可升华,在粗碘中加入一种物质后,再进行升华可以制得纯碘,应加入的物质是( )
A.H2O B.Zn C.KI D.NaCl
21.下列各物质中,后一种物质的热稳定性比前一种强的是( )
A.Na2CO3和NaHCO3 B.Na2O2和Na2O
C.K2MnO4和KMnO4 D.HBr和HCl
22.核内中子数为N的R2+离子,质量数为A,则n克它的氧化物中所含质子数的物质的量是( )
A. ![]() (A-N+8)mol B.
(A-N+8)mol B. ![]() (A-N+10)mol
(A-N+10)mol
C.(A-N+2)mol D.
![]() (A-N+6)mol
(A-N+6)mol
23.甲乙两种非金属:
①甲比乙容易与H2化合②甲原子能与乙阴离子发生置换反应③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强④与某金属反应时,甲原子得电子数目比乙的多⑤甲的单质熔、沸点比乙的低
A.只有④ B.只有⑤ C.①②③ D.①②③④⑤
24.有关过氧化氢(H2O2),下列叙述不正确的是( )
A.H2O2的沸点比水高,但受热容易分解。欲使7%~2%的H2O2溶液缩成30%溶液采用的适宜方法是减压蒸馏
B.H2O2中的氧元素为-1价,它的水溶液俗称双氧水,呈弱酸性
C.有反应2H2O2![]() 2H2O+O2↑,因此实验室里,常用过氧化氢制取O2
2H2O+O2↑,因此实验室里,常用过氧化氢制取O2
D.H2O2的电子式是:H+[∶![]() ∶
∶![]() ∶]2-H+
∶]2-H+
25.有反应:2Na2S+Na2SO3+3H2SO4![]() 3S↓+3Na2SO4+3H2O
3S↓+3Na2SO4+3H2O
现将含有amolNa2SO3的溶液与含bmolNa2S溶液混和后再滴入稀H2SO4立即出现浅黄色的S沉淀。
有关叙述不正确的是( )
A.若a∶b>1∶2,生成S和SO2 B.若a∶b=1∶2,只生成S
C.若a∶b<1∶2,生成S和H2S D.若0<a∶b≤1∶3,同时生成S、SO2、H2S
三、选择题
26.纯净的Ca(HCO3)2试样在高温下分解,当剩余的固体质量为原试样质量的一半时,Ca(HCO3)2的分解率是( )
A.50% B.75% C.92.7% D.100%
27.经实验测得,把等物质的量浓度的NaOH溶液逐滴滴入CuSO4溶液中,两者体积比为1.5∶1时(残存在溶液中的Cu2+极少,可认为全部转入沉淀中),所生成沉淀的化学式是( )
A.Cu(OH)2 B.Cu(OH)2·CuSO4
C.2Cu(OH)2·CuSO4 D.3Cu(OH)2·CuSO4
28.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):( )
①G![]() Q+NaCl ②Q+H2O
Q+NaCl ②Q+H2O![]() X+H2 ③Y+NaOH
X+H2 ③Y+NaOH![]() G+Q+H2O ④Z+NaOH
G+Q+H2O ④Z+NaOH![]() Q+X+H2O这五种化合物中氯的化合价由低到高的顺序为( )
Q+X+H2O这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
29.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaCl中的一种或几种组成。将该粉末:①与足量盐酸反应有气体放出,将气体通过足量的NaOH②原粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原粉末的质量。
下列判断正确的是( )
A.粉末中一定是Na2O、Na2O2、NaHCO3 B.粉末中一定不含有Na2CO3和NaCl
C.粉末中一定不含有Na2O和NaCl D.粉末中一定不含有Na2O2和Na2CO3
30.A、B、C是周期表中相邻的三种元素,其中A、B同周期,B、C同主族。这三种元素在周期表中的位置可能有以下四种排列方式:

当此三种元素质子数总和为31,三种元素原子最外层电子数之和为17。则A、B、C应是( )
A.A、B在周期表中第4周期,C在周期表中ⅤA族
B.A、B在周期表中第3周期、,A在周期表中ⅥA族
C.A、B在周期表中第2周期,C在周期表中ⅥA族
D.A、B在周期表中第1周期,C在周期表中O族
31.根据人们的实践经验,一般说来,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,根据这个实践经验,下列叙述不正确的是( )
A.氯化氢易溶于水,不易溶于苯(非极性分子)
B.碘易溶于CCl4(非极性分子),也易溶于水
C.食盐易溶于水,不易溶于汽油(非极性分子的混合物)
D.硫难溶于水,易溶于CS2液体中
四、填空
32.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)。
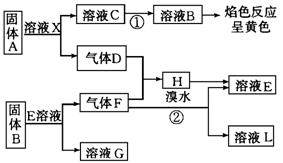
请回答:
(1)固体A是 (写化学式)
(2)反应①的化学方程式:
(3)反应②的化学方程式:
33.(1)短周期元素X、Y、Z在周期表中位置关系如下图所示。
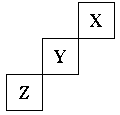
①X元素的单质分子式是 。
若X核内中子数与质子数相等,X单质的摩尔质量是 。
②Y单质的电子式是
Y单质与水反应的化学方程式:
Z与钙形成的化合物的电子式是:
(2)已知下列元素的原子半径:
| 元 素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径(10-10m)可能的范围是 。(3)若X′、Y′是第1周期以外的短周期元素,它们可以形成化合物X′mY′n,且离子均具有稀有气体原子的电子层结构,则X′、Y′两原子的原子序数a、b的关系可表示为 、 、 。
34.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处的风化作用是说矿物与H2O和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式是:
2KASi3O8+11H2O+2CO2![]() 2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4这个反应能发生的原因是
。
2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4这个反应能发生的原因是
。
五、实验题
35.浓H2SO4和浓KClO3溶液反应,生成黄色气体ClO2(实验时小心将浓H2SO4逐滴滴入浓KClO3溶液中,且ClO2气体具有爆炸性),反应方程式如下:
KClO3+H2SO4(浓) ![]() KHSO4+HClO3
KHSO4+HClO3
3HClO3![]() HClO4+H2O+2ClO2
HClO4+H2O+2ClO2
2ClO2![]() Cl2+2O2
Cl2+2O2
(1)设计一个实验,确定ClO2分解产物中O2与Cl2的体积比为2∶1(不需叙述HClO3的生成和分解的实验)。
(2)ClO2也能像Cl2一样,在强碱(如KOH)溶液中发生反应,其化学方程式是: 。(注意:反应产物除有水生成外,有氯化物和+5的氯的含氧酸盐)
36.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答以下问题:
①雨水样品的pH变化的原因(用化学方程式表示):
②如果将刚取样的上述雨水和自来水混和,pH将变 。(填“大”、“小”、“不变”)
(2)你认为减少酸雨产生的途径可采用的措施是 。
①少用煤作燃料 ②把工厂烟囱造高 ③燃烧脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①②⑤ D.①③④⑤
(3)在英国进行了一个研究,结果表明:高烟囱可以有效地降低其周围地表面SO2浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱,结果使附近地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
六、计算
37.两份不同浓度的NaOH溶液各500mL,分别吸收1120mL,反应后溶液中分别有5.75g和7.1g溶质。求两份NaOH溶液的物质的量浓度。
(提示:SO2与NaOH反应时,当反应物间的物质的量比值不同,会有正盐或酸式盐生成)
38.使一定质量的锌与100mL18.5mol/L浓H2SO4充分反应,锌完全溶解,同时生成气体A33.6L(标准状况下)。将反应后的溶液稀释至1L,测得溶液c(H+)为0.1mol/L,求气体A中各组分的体积比。
(提示:浓H2SO4与Zn反应时,随着反应的进行H2SO4由浓逐渐变稀、相应生成的气体也不同)
参考答案
一、1.A 2.A 3.A 4.B 5.C 6.A 7.B 8.C 9.C 10.C
二、11.C 12.AD 13.D 14.C 15.D 16.BD 17.D 18.BD 19.A 20.C 21.D 22.A 23.C 24.D 25.D
三、26.D 27.D 28.B 29.A 30.C 31.B
四、32.(1)Na2O2 (2)SO2+NaOH=NaHSO3 (3)SO2+Br2+2H2O=H2SO4+2HBr 33.(1)①He4g/mol ②∶![]() ∶
∶![]() ∶,2F2+2H2O=4HF+O2↑ Ca2+[
∶,2F2+2H2O=4HF+O2↑ Ca2+[![]()
![]()
![]() ]2-
]2-
(2)1.02×10-10m~1.17×10-10m。 (3)a=b+m+n,a=b+m+n-8,a=b+m+n-16
34.因为碳酸的酸性比原硅酸酸性强,由较强的酸可制得较弱的酸。
五、35.(1)取一刻度试管(或量筒),用排饱和食盐水法收集Cl2和O2混和气体,记下混和气体总体积数,然后将盛有混和气体的器皿倒扣于NaOH溶液中,直到NaOH溶液在器皿中的液面不再上升时,计下刻度数,求出上升液面刻度数与总体积减去上升液面刻度数之比。(得出V(Cl2)∶V(O2)≈1∶2,再按题回答)
(2)6ClO2+6NaOH=NaCl+5NaClO3+3H2O
36.(1)①2H2SO3+O2=2H2SO4②小;H2SO3+HClO=H2SO4+HCl或与SO2+Cl2+2H2O=H2SO4+2HCl (2)C (3)不可取。因为SO2的排放总量没有减少,所以形成的酸雨仍会对全球造成危害。
六、36.解:SO2与NaOH反应时可能有:
SO2+2NaOH=Na2SO3+H2O SO2+NaOH=NaHSO3
1120mLSO2可生成0.05molNa2SO3或Na2SO3和NaHSO3
含液质7.1g的一定含Na2SO3和NaOH
第一份液中:
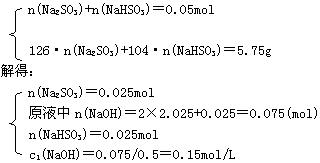
第二份液中含Na2SO3 0.05mol质量6.3g,m(NaOH)=7.1-6.3=0.8g
原液中n(NaOH):2×0.05+0.8/40=0.12mol c2(NaOH)=0.12/0.5=0.24mol/L
37.解:反应后c(H+):0.1mol/L则c(H2SO4):0.05mol/L n(H2SO4)∶0.05mol/L
设A混合气体中n(SO2)为x,n(H2)为y
Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y
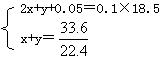
解得: x=0.3mol y=1.2mol
则:V(SO2)∶V(H2)=(0.3×224)∶(1.2×22.4)=1∶4