高一下学期第三次周练化学试题(氧族元素、二氧化硫)
答题可能需要的相对原子质量:H:1 O:16 S:32 K:39
一、选择题(本题包括15小题,每小题3分,共45分)
1.随着核电荷数的递增,下列关于氧族元素性质的叙述中,错误的是
A. 单质的导电性逐渐增强 B. 元素的非金属性逐渐增强
C. 氢化物的稳定性逐渐减弱 D. 单质的熔、沸点逐渐升高
2. 若已发现了116号元素R,则下列叙述正确的是
①其钠盐的分子式为Na2R;②其最高价氧化物的水化物是强酸;③R是金属元素;④R是非金属元素;⑤其最高价氧化物的分子式为RO3。
A. ①③和⑤ B. ②和④ C. ③和⑤ D. ②③和⑤
3.不能说明氯的非金属性比硫强的事实是
A. HCl受热不分解,H2S受热分解
B. 向H2S的水溶液中通入氯气溶液变浑浊,反应方程式为H2S+Cl2==S↓+2HCl
C. 与Na化合时,硫显-2价,氯显-1价
D. 与Fe化合时,硫将Fe氧化至+2价,氯将Fe氧化至+3价
4.下列关于O3的说法中错误的是
①O3具有刺激性性臭味,因此被称为“臭氧”②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水 ④O3比O2稳定,高温下不易分解
⑤O3有漂白和消毒作用 ⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好 ⑦空气中高压放电、高压电机和复印机工作都会有O3生成
A. ①②③ B. ④⑤⑥ C. ④⑥ D. ⑤⑦
5. 在标准状况下,将100mLO2充入臭氧发生器中,最后气体体积变为95mL(标准状况),则最终状态时混合气体的密度(标准状况下)是
A.1.9 g·L-1 B.1.7 g·L-1 C.1.5 g·L-1 D.1.3 g·L-1
6.0.05mol某单质与0.8g硫在一定条件下完全反应,该单质可能是
A H2 B O2 C K D Zn
7.下列说法中不正确的是
A.硫是一种淡黄色的能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫.
8.已知反应:3S+6KOH![]() 2K2S+K2SO3+3H2O,下列说法正确的是
2K2S+K2SO3+3H2O,下列说法正确的是
A. S是氧化剂,KOH是还原剂
B. 若3mol硫完全反应,则反应中共转移了4mol电子
C. 还原剂与氧化剂的质量比是1:2
D. 氧化产物和还原产物的物质的量之比为3:2
9. 某种单质硫的分子由x个硫原子组成,取nmol这种硫的单质,在足量的氧气中完全燃烧生成8nmolSO2。关于这种单质的结论不正确的是
A. 化学式为S8 B. 相对分子质量为256
C. 1mol该单质硫的质量为256g D. 1mol这种单质完全燃烧需1mol氧气
⒑下列物质能使品红溶液褪色的是
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
A. ②③④⑤ B. ①②③ C. ①④⑤ D. 全都可以
11. 用0.1mol/LNa2SO3溶液20mL,恰好将1.0×10-3molXO4-还原,则X元素在反应后所得还原产物中化合价为
A. +3价 B. +2价 C. +1价 D. 0价
12. 造成大气污染的SO2主要来源于
A. 自然界硫化物分解 B. 大量含硫燃料燃烧
C. 火山喷发 D. 金属矿石的冶炼
13. 为了检验SO2中是否含有少量的CO2气体杂质,其下列操作正确的是
A. 先通入水中,再通入澄清石灰水中
B. 先通入品红溶液
C. 先通入酸性KMnO4溶液,再通入澄清石灰水中
D. 通入澄清石灰水中
14.已知硫化氢和二氧化硫气体可发生如下反应:2H2S+SO2==3S↓+2H2O。向20L真空容器中通入amolH2S和bmolSO2(a,b都是正整数,且a≤5,b≤5),反应完全后,容器内气体可能达到的最大密度约是
A. 24.5g/L B. 14.4 g/L C. 8 g/L D. 5.1g/L
15. 工业上从硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸。加入盐酸共热,硒酸被转化为亚硒酸(2HCl+H2SeO4==H2SeO3+Cl2+H2O),再将SO2通入亚硒酸的溶液中,单质硒即析出。下列叙述正确的是
A. H2SeO4的氧化性弱于Cl2 B. 亚硒酸氧化性强于亚硫酸
C. 亚硒酸的还原性强于亚硫酸 D. 析出1molSe需H2SeO3、SO2、H2O各1mol
班级 姓名 得分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | ~~~ |
| ~~~ |
二、填空题:(本题包括5小题,共47分)
16.(5分)用有关符号填写:
氧、硫、硒、碲中,原子半径最小的是 ,单质氧化性最强的是 ,半径最大的阴离子是 ,还原性最弱的阴离子是 ,气态氢化物热稳定性最强的是 ,最高价氧化物的水化物酸性最弱的是 。在氧、硫、硒、碲四种元素形成的单质中,不能导电的是 ,可做半导体的是 ,能导电的是 。
17. (9分)过氧化氢(H2O2)俗名双氧水,医疗上用作外科消毒剂。
⑴向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水具有_____性。 ⑵将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出______性。⑶久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为_____________________________________________________。
18.(9分)我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
⑴现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)__________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变_______,原因是(用化学方程式表示)_______________________________________________。
⑵你认为减少酸雨产生的途径可采用的措施是__________。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;
⑤开发新能源。
A. ①②③ B. ②③④⑤ C. ①③⑤ D. ①③④⑤
19.(12分)已知A是一种有刺激性气味的无色气体,能使品红溶液褪色;B是一种黄绿色气体;E、F均为不溶于水也不溶于酸的白色固体。下图是几种物质间相互转化的关系。
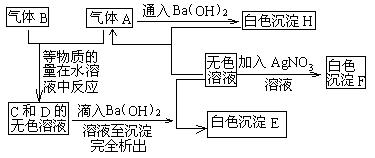 |
试回答下列问题:
⑴A是 ,B是 (写化学式)
⑵写出实验室制取气体B的化学方程式:
。
⑶写出A、B等物质的量在水溶液中反应的离子方程式
。
⑷试分析气体A使品红试液褪色的原理
。
20.(12分)已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O。某无色溶液可能含有下列钠盐中的几种:A.氯化钠 B.硫化钠 C.亚硫酸钠 D.硫代硫酸钠(Na2S2O3) E.硫酸钠 F.碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体放出。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红溶液褪色。根据上述实验现象回答下列问题。
⑴不能使品红溶液褪色,说明该气体中不含 (填写化学式)
⑵此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)
第一种情况是 ,第二种情况是 ,第三种情况是 ,第四种情况是 。(可不填满,也可补充)
三、计算题(8分)
21.硫通常是一种淡黄色晶体,有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个硫分子中硫原子个数不同,可用Sx表示。对三种蒸气测定的结果是:
⑴橙色蒸气密度折算至标况后是11.43 g·L-1,则它的化学式是 。
⑵红棕色蒸气的质量是相同状况时同体积空气的6.62倍,则它的化学式是 。
⑶无色蒸气对氢气的相对密度是64,则它的化学式是 ,此事实说明硫有 。
参考答案:
一、选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | C | C | C | C | C | A、D | B、c |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | ~~~ |
| D | D | A | B、D | C | B | B | ~~~ |
二、填空题
16. O O2 Te2- O2- H2O H2TeO4 O2 S Se Te
17.氧化性 还原性 PbS+4H2O2==PbSO4 + 4H2O
18. ⑴①2H2SO3+O2===2H2SO4 ②变小 H2SO3+HClO==H2SO4+HCl
⑵ C(①③⑤)
19. ⑴A:SO2 B:Cl2 ⑵ ![]()
⑶SO2+Cl2+2H2O===4H++SO42-+2Cl- ⑷ SO2与有色物质结合成无色的物质
20. ⑴SO2 ⑵ B C F ; B D F
三、计算题:
21. ⑴ S8 ⑵ S6 ⑶ S4 同素异形体