高一下学期第一次月考化学试题(物质结构元素周期律)
班级 姓名 得分
考试时间为90分钟。
一、选择题(本题包括16小题,每小题3分,共48分)
1.19世纪门捷列夫的突出贡献是
A.提出了原子学说 B.提出了分子学说
C.发现了稀有气体 D.发现了元素周期律
2.已知元素X的某原子的质子数为Z,中子数为N,下列说法正确的是
A.不能由此确定元素X的相对原子质量 B.元素X的相对原子质量为Z+N
C.1molX原子的质量为(Z+N)g D.X的摩尔质量为(Z+N)g
3.氯只有![]() 和
和![]() 两种稳定同位素,它们在氯气中的原子数之比
两种稳定同位素,它们在氯气中的原子数之比![]() ︰
︰![]() 为
为
3︰1。则分子量为70、72、74的氯气分子数之比可能是
A.5︰2︰1 B.5︰2︰2 C.9︰3︰1 D.9︰3︰2
4.下列说法正确的是
A.难失电子的原子,得电子的能力一定强
B.易得电子的原子,失电子的能力一定弱
C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大
D.任何原子的原子核都是由质子和中子构成的
5.元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中,R元素的化合价为
A.12-3n B.3n-12 C.3n-10 D.6-3n
6.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W D.金属性:X>Y,还原性:W2->Z-
7. a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是
A.b、a、e、d、c B.e、d、a、b、c
C.a、b、d、c、e D.c、d、e、a、b
8.A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是
A.原子序数:A<B B.A和B可能在同一主族
C.A可能在第2周期ⅣA族 D.A肯定是金属元素
9.含硒(Se)的保健品已开始进入市场。已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
10. 已知同周期的X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的次序是:HZO4>H2YO4>H3XO4,下列说法中正确的是
A. 三种元素的原子序数按Z、Y、X的次序增大
B. 单质的氧化性按X、Y、Z的顺序减弱
C. 原子半径按X、Y、Z顺序增大
D. 气态氢化物的稳定性按X、Y、Z的顺序增强
11.由短周期元素形成的化合物A2B3,A3+比B2-少一个电子层。则下列说法中正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A、B不在同一周期 D.B是第三周期第ⅣA族的元素
12.下列叙述中,肯定a金属比b金属活泼性强的是
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
|
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molY的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
14.有aXn-和bYm+两种离子,其电子层结构相同,下列关系或化学式不正确的是
A.a+m==b-n B.Y的硫酸盐为Y2(SO4)m或![]()
C.X的氢化物为HnX或XHn D.X一定有最高价的含氧酸,化学式为HnXO4
15.下列表达方式错误的是
A 甲烷的电子式 ![]() B 氟化钠的电子式
B 氟化钠的电子式 ![]()
C 硫离子的结构示意简图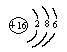 D 碳-12原子
D 碳-12原子 ![]() C
C
16.两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为 ① m-4 ②m+4 ③m+8 ④m-2 ⑤m+6
A.①②④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
选择题答题栏:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
二、填空题(本题包括4小题共32分)
19.(5分)元素周期律是指元素的性质随___________的递增,而呈_______ 性变化的规律,这里元素的性质主要是指_____________ 和_____________ ;元素性质周期性变化是__________________________呈周期性变化的必然结果。
20.(7分)有下列四种微粒:①![]() O、②
O、②![]() Na、③
Na、③![]() Mg、④
Mg、④![]() N
N
(1)按原子半径由大到小顺序排列的是__________________________
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________,能形成X3Y2型化合物的是___________。
21.(10分)有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华。
(c)X由A、C组成,分子中原子个数比为A:C=1:1。
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2。
试回答下列各小题:
⑴各元素符号:A B C D E
⑵W的电子式: 。
⑶X的结构式: 。
⑷Y的电子式: 。
⑸Z的化学式: 。
⑹写出Y与水反应的化学方程式: 。
22.(10分)现有A、B、C、D四种元素,它们的核电荷数依次增大。①A的核电荷数小于10,可形成气态氢化物,该物质在常温下为液体。②A和B两种元素可形成化合物B2A3,该化合物既能溶于强酸,又能溶于强碱。③C的+1价离子C+比B3+离子多8个电子。④C和D可形成化合物CD。⑤CD溶液中通入Cl2后,加淀粉变蓝色。
⑴这四种元素的元素符号为A: B: C: D:
⑵B2A3分别与H2SO4、NaOH溶液反应的离子方程式:
; 。
⑶C的单质与A的氢化物能不能反应?若能反应,写出化学方程式:
⑷用电子式表示CD的形成过程:
写出CD化合物与Cl2反应的离子方程式
三、计算题(本题包括2小题,共20分)
23.(8分)某元素同位素的氯化物XCl21.11g 配成溶液后,需用1mol/L的AgNO3溶液20mL,才能把氯离子完全沉淀下来。已知同位素中有20个中子,求:
⑴X的质量数为多少?
⑵指出X在周期表中的位置(周期、族)。
⑶把X单质放在水中,有何反应现象?滴入的酚酞呈现什么颜色?写出有关的化学方程式。
24.(12分)A、B、C是短周期IA和IIA族元素的碳酸盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为![]() 。
。
已知:![]()
请填空:
(1)写出短周期IA和IIA族元素形成的所有碳酸盐的名称:______________ 。
(2)若以MA、MB、MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式____________________________。
(3)A的正确选择有____________种,其化学式为:____________________。
(4)若A和B为IIA族元素的碳酸盐,C为IA族元素的碳酸盐,则A、B、C的化学式依次为________________mB∶mC=1∶_________。(保留2位小数)
参考答案:
一、选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | A | A、D | B | B | A、C | A | A、C |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | D | B | D | C、D | D | C | D |
二、填空题:
19. 原子序数 周期 原子半径 主要化合价 元素原子核外电子排布
20. ⑴ ②>③>④>① ⑵ ①② ⑶ ④ ⑷ ①② ;③④。
21. ⑴ A:H B:C:C:O D:Na E:S
⑵![]() ⑶ H-O-O-H
⑶ H-O-O-H
⑷ ![]() ⑸ Na2S
⑸ Na2S
⑹ 2Na2O2+2H2O==4NaOH+O2↑
22. ⑴ A:O B:Al C:K D:I
⑵ Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O
⑶ 能 2K+2H2O=2KOH+H2↑
⑷ ![]() Cl2+2I-===2Cl-+I2
Cl2+2I-===2Cl-+I2
三、计算题
23. ⑴X的质量数为40 ⑵X元素在第4周期ⅡA族 ⑶反应剧烈,有气体放出,滴入酚酞后溶液呈红色。 Ca+2H2O==Ca(OH)2+H2↑
24. (1)碳酸锂,碳酸钠,碳酸铍,碳酸镁。
(2)![]() 以及其它合理答案)
以及其它合理答案)
(3) 2 Li2CO3 MgCO3 (4)MgCO3,BeCO3, Na2CO3 1:1.05