高一下学期第一次周练化学试题(原子结构、周期律)
班级 姓名 得分
一、选择题(本题包括15小题,每小题3分,共45分)
1.某粒子用![]() 表示,下列关于该粒子的叙述正确的是
表示,下列关于该粒子的叙述正确的是
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.质量数=Z+A
2.据报道,某些建筑材料会产生放射性同位素氡![]() ,从而对人体产生伤害,该同位素原子的中子数和质子数之差是
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是
A 136 B 50 C 86 D 222
3. 科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该元素的下列叙述正确的是
A. 其原子核内中子数和质子数都是112
B. 其原子核内中子数为165,核外电子数为112
C. 其原子质量是12C原子质量的277倍
D. 其相对原子质量与12C相对原子质量之比为277:12
4. 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich 等人为此获得2002年度诺贝尔化学奖。下面有关13C、15N的叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
5下列有关电子云及示意图的说法正确的是
A. 电子云是笼罩在原子核外的云雾 B. 小黑点多的区域表示电子多
C. 小黑点疏的区域表示电子出现机会少 D. 电子云是用高速照相机拍摄的照片
6.在bXm-和aYn+两种微粒,它们的电子层结构相同,则a,m,n,b的关系是
A. a=b-m-n B. b+m+n=a C. a=b-m+n D. m-n+b=a
7. 下列叙述中,正确的是
A. 两种粒子,若核外电子排布完全相同,则其化学性质一定相同
B. 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C. 两原子,如果核外电子排布相同,则一定属于同种元素
D. 阴离子的核外电子排布一定与比它原子序数小的稀有气体元素原子的核外电子排布相同
8. 实际存在的![]() H、
H、![]() H、
H、![]() H、H+和H,它们是
H、H+和H,它们是
A. 氢的五种同位素 B. 五种氢元素
C. 氢元素的五种不同微粒 D. 氢的五种同素异形体
9.下列各组元素的原子随着原子序数的递增,有关递变不正确的是
A. 原子半径:C>N>O>F B. 金属性:Na<K<Rb<Cs
C. 最高正价:P<S<Cl<Ar D. 最外层电子数:Na<Mg<Al<Si
10. 电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积在标准状况下为33.6L。在所生成的气体中,重氢D和普氢H的原子个数比为
A. 2:3 B. 2:5 C. 1:2 D. 1:3
11.已知氢化锂(LiH)属于离子化合物;LiH跟水反应可以放出氢气,下列叙述正确的是
A. LiH的水溶液显中性 B. LiH中的氢离子可以被还原成氢气
C. LiH是一种强氧化剂 D. LiH中氢离子比锂离子的半径大
12.下列各反应的离子方程式中,有错误的是
A. 氢氧化铝与盐酸反应:Al(OH)3+3H+==Al3++3H2O
B. 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-==2AlO2-+H2O
C. 碘化钾溶液中滴入溴水:2I-+Br2==I2+2Br-
D. 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-==AlO2-+3H2O
13.已知aAn+、bB(n+1)+、cCn-、dD(n-1)-均具有相同的电子层结构,对于A、B、C、D四种元素的叙述,正确的是
A. 原子半径:A>B>C>D B. 原子序数:b>a>c>d
C. 离子半径:D>C>B>A D. 金属性:B>A;非金属性:D>C
14. 下列关于物质性质变化的比较不正确的是
A. 酸性:HNO3>H3PO4>H2SiO3 B. 碱性:LiOH>NaOH>KOH
C. 原子半径:O<S<Na D. 还原性:I-<Cl-<F-
15. 有X、Y、Z三种元素,它们的原子序数均小于20,X元素的原子最外电子层只有一个电子,Y元素的原子第M层的电子数是K层和L层电子总数的1/2,Z元素的原子L电子层比Y元素原子的L层少2个电子,由X、Y、Z组成的化合物的化学式不可能是
A. X2YZ2 B. XYZ3 C. X3YZ4 D. X4YZ4
选择题答题栏:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | ~~~ |
| ~~~ |
二、填空题(本题包括6小题,共43分)
16.(9分)用A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数 填写下列空白:
⑴同位素种类由 决定; ⑵元素种类由 决定;
⑶元素有同位素由 决定; ⑷同位素相对原子质量由 决定;
⑸元素的原子半径由 决定; ⑹元素的化合价主要由 决定;
⑺元素的化学性质主要由 决定; ⑻价电子数通常是指 ;
⑼核电荷数由 决定。
17.(8分)画出下列各微粒的结构示意图:
⑴与Ne原子电子层结构相同的-2价阴离子__________;
⑵最外层电子数为次外层电子数两倍的原子__________;
⑶L层电子数为K层、M层电子数之和的原子__________;
⑷M层电子数为K层电子数四倍的阳离子___________。
18.(4分)在一定条件下,RO3n-和I-发生离子反应如下:RO3n-+6I-+6H+==R-+3I2+3H2O。
⑴RO3n-中R元素的化合价是________;⑵R元素的原子最外层电子数是__________。
19.(6分)在1-20号元素中的几种微粒的电子层结构均为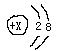 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号:
⑴A微粒一般不与其它物质发生反应,则A为 ;
⑵B微粒对应的原子中,L层电子数是K层电子数的3倍,则B为 ;
⑶C微粒氧化性很弱,但获得一个电子后形成的电中性的原子还原性很强,则C为 ;
⑷D微粒与H+相结合形成的化合物能腐蚀玻璃,则D为 ;
⑸E微粒1mol可与2molOH-形成一种白色难溶的固体,则E为 。
20.(7分)有A、B、C、D、E五种元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1:1或2:1形成化合物。CB可与EA2反应生成C2A与气态物质EB4。E的M层电子数是K层电子数的2倍。
⑴写出这五种元素的名称:
A__________;B_________;C__________;D__________;E____________。
⑵画出E的原子结构简图____________。
⑶写出D的单质与铜盐溶液反应的离子方程式
___________________________________ 。
21.(9分)有X、Y、Z三种元素,其中X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性。在其氧化物中,Y的质量分数分别是62%和78%。在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色。Z和X的原子最外层电子数相等。试回答:
⑴元素符号:X________,Y_________,Z__________。
⑵Y的两种氧化物为____________和___________。用化学方程式解释它们的水溶液呈碱性的原因。
_________________________________________________________________
⑶Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,发生了________反应。有关反应的离子方程式为_____________________________________________________。
三、计算题:(本题12分)
22. 0.8gA的单质与稀盐酸充分反应放出0.04g H2,B元素的阴离子结构与氩原子相同,B的气态氢化物的水溶液是强酸。
⑴求A的相对原子质量及化合价;
⑵写出A、B两元素的符号及B的气态氢化物的化学式;
⑶写出由A、B组成的化合物与Na2CO3溶液反应的离子方程式。
附加题:原子序数为1-20号元素中,某两种元素的原子序数相差3,电子层数相差1,它们形成化合物时原子数之比为1:2。试写出这些化合物的化学式。