高一化学第二学期期中考试
高 一 化 学 试 卷
满分:100 时间100分钟 制卷人;吴一平
可能用到的相对原子质量:H-1 O-16 Na-23 Cl-35.5 S-32 Al-27 Fe-56 Cu-64 Ba-137
第I卷 选择题(50分)
一、选择题(每小题只有1个选项符合题意,10×2分=20分。)
1.下列情况可能引起大气污染的是
①煤的燃烧 ②工业废气的任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A.只有①② B.只有②④
C.只有①②③ D.①②③④
2.元素的化学性质主要决定于原子的
A. 质子数 B.中子数 C.核外电子数 D.最外层电子数
3、某元素R,它的最高价氧化物的化学式是RO3,则其气态氢化物的化学式是
A.HR B.H2R C.RH3 D.RH4
4.19世纪中叶,门捷列夫的突出贡献是
A.发现元素周期律 B.提出原子学说
C.提出分子学说 D.最早发现氧气
5.下列化合物中,阴离子半径与阳离子半径之比最大的是
A.LiI B.NaBr C.KCl D.CsF
6.下列关于![]() 、
、![]() 、
、![]() 的说法正确的是
的说法正确的是
A.它们的性质完全相同 B.它们是碳元素的同素异形体
C.它们是碳元素的三种单质 D.它们是碳元素的三种同位素
7.关于化学键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键
B.非极性键只存在于双原子的单质分子里
C.共价化合物里,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
8.比原子序数为11的元素原子少一个电子而又多一个质子的微粒是
A.Na+ B.Na C.Mg2+ D.Mg
9.硫的非金属性弱于氯的非金属性,其最主要的事实是
A.硫不溶于水,而氯气溶于水
B.通常状态下硫为淡黄色晶体,而氯气为黄绿色气体
C.在与金属形成的化合物中硫为-2价,而氯为-1价
D.在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态
10.X、Y、Z在同一短周期,X、Y、Z分别易形成X-、Y+、Z2+离子,它们的半径之间存在的关系是
A.X>Y>Z B.Y+>Z2+>X-
C.Y+>X->Z2+ D.X->Y+>Z2+
二、选择题(每小题有1~2个选项符合题意,15×2分=30分。)
11.下列关于物质性质变化的比较, 不正确的是:
A. 酸性强弱: HF > HCl > HBr > HI B. 原子半径大小: Na > S > O
C. 碱性强弱: KOH > NaOH > LiOH D. 还原性强弱: F- > Cl- > I-
12.下列变化中,不需要破坏化学键的是
A.食盐熔化 B.干冰气化
C.氯化氢溶于水 D.氯化铵受热分解为氨气和氯化氢
13.与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.MgBr2 B.Na2S C.CCl4 D.KF
14. 某阳离子Rn+的核外共有x个电子,核内有y个中子,则R的质量数是
A.y-x-n B.y-x+n C.y+x+n D.y+x-n
15.下列物质中含有极性键的化合物是
A.NaOH B.Na2O2 C.CO2 D.NaCl
16.硫酸用途极广,但不用于下面情况的是
A.医药工业 B.蓄电池 C.制盐酸 D.制炸药
17.某溶液中加入BaCl2溶液生成白色沉淀,再加入稀硝酸沉淀不溶解,则这种溶液中
A.一定含有![]() B.可能含有
B.可能含有![]() 或
或![]()
C.一定含有Ag+
D.可能含有![]() 或Ag+
或Ag+
18通常不能用单质和单质化合反应直接得到的是
A.FeS B.Cu2S C.H2Te D.HI
19.a元素的阴离子、b元素的阴离子、c元素的阳离子具有相同的电子层结构。且a的原子序数大于b的原子序数,则a、b、c三种离子半径大小的顺序是
A.a>b>c B.b>a>c C.c>a>b D.c>b>a
20.下列物质中各元素原子的最外层电子全部参加成键的是
A.H2O B.HF C.CO2 D.CH4
21.某无色溶液中通入一定量的SO2气体后,立即产生了白色沉淀,该溶液中可能含有的微粒是
A.Ba2+、![]() 、H+
B.Cl2、Na+、Cl-
、H+
B.Cl2、Na+、Cl-
C.Ba2+、Cl-、OH- D.Ba2+、Cl-、H+
22.欲使0.1molCu被浓H2SO4完全氧化,所取18.4mol/L的浓H2SO4的体积是
A.5.5mL B.小于10mL C.10.9mL D.大于11mL
23.将H2S、SO2和SO3各0.01mol依次溶解于1L水中,则该溶液肯定具有
A.中性、漂白性 B.酸性、漂白性
C.只有酸性 D.只有漂白性
24、已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,则下列说法中正确的是
A.生成1molCl2转移6mole- B.生成的氯气式量约为74
C.生成的KCl中只含有37Cl D.生成的氯气中既有35Cl又有37Cl
25.下列关于氯气和二氧化硫两种气体的说法中,正确的是
A. 二氧化硫和氯气都是强的氧化剂
B. 在通常状况下,二氧化硫比氯气易溶于水
C. 将二氧化硫和氯气以等物质的量混合后,通过品红溶液,漂白效果是二者作用效果之和。
D. 二氧化硫和氯气都能污染大气,都可以用碱液吸收
第II卷 非选择题(50分)
三、填充题(共34分)
26.(5分)(1)根据元素周期律,第116号元素应处于第 周期,第 族,它属于 (填“金属”或“非金属”)元素。
(2)已知SO2遇H2S气体时表现出氧化性,发生如下反应:SO2+2H2S=3S+2H2O,在标准状况下,向一个容积为1L的容器里加入![]() L的SO2和
L的SO2和![]() L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
27.(5分)氢化锂是一种离子化合物,LiH与H2O反应放出H2。
(1)写出反应的化学方程式: , 反应后所得溶液呈 性(用“酸”或“中”或“碱”填)。
(2)LiH的电子式 ,微粒半径:H-- Li+(用“<”或“=”或“>”填)。
28.(14分)现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
⑴A、B、C、D、E各是什么元素(写元素名称):
A______、B_____、C_____、D_______、E________ 。
⑵A的原子结构示意图___________,B的离子结构示意图_________
D的单质分子的电子式________, C元素最高价氧化物的水化物的电子式_______
⑶写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
___________________________,___________________
⑷比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径:____ ___ __;氧化性:_________ _________。
(5)写出E与冷水反应的化学方程式:
___________________ ________。
29.(4分)在1H216O、D232S、3H218O、32S17O2、2H232S、32S16O2中共有_______(填“字母”)
A.2种元素 B.3种元素 C.8种原子 D.7种原子
E.6种分子 F.5种分子
四.实验题(10分)
30.(提示:酸性高锰酸钾溶液可把SO2氧化成H2SO4),如图,回答下列问题
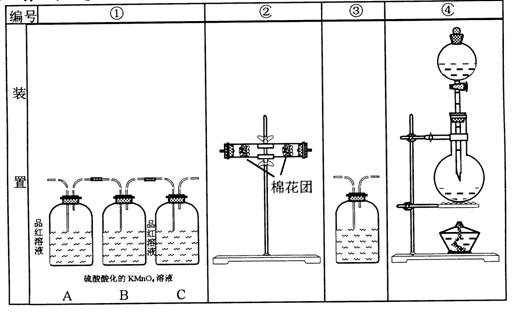 ⑴浓硫酸与木炭粉在加热条件下反应的化学方程式是
⑴浓硫酸与木炭粉在加热条件下反应的化学方程式是
____ ________;
⑵试用上图所示各装置设计一个实验,来验证上述反应所产生的各种产物,这些装置的连接顺序(气流从左至右的方向)是(填装置的编号):
____→____→____→______。
⑶实验时可观察到装置①中A瓶溶液__________,C瓶溶液__________,
B瓶溶液的作用是______ ____。
⑷装置②中所加的固体药品是_____________,可验证的产物是 ________。
⑸装置③发生反应的离子方程式是________________。
五.计算题(共12分)
31.(5分)某Na2SO3试剂已部份被氧化为Na2SO4,为确定其纯度,进行如下实验:①称取样品A g; ②将样品溶解; ③向溶液中加入稍过量的盐酸酸化的BaCl2溶液; ④过滤、洗涤、干燥沉淀,称其质量为Bg。试回答:
(1)BaCl2溶液要用盐酸酸化且过量的原因是
。
(2)沉淀需洗涤的原因及判断沉淀已经洗净的方法分别是
(3)Na2SO3的纯度表达式Na2SO3%= 。(用含A、B的式子表示)
32.(7分)0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素中子比质子多一个。求R的相对原子质量及在元素周期表中的位置。