高一化学第二学期期中考试试卷2
注意:1.本试卷满分100分,附加分5分,考试时间100分钟。
2. 本次考试不能用计算器,答案一律做在答卷页上
一.选择题:(共54分,1——20题为单选题,21——25题为多选题)
1.19世纪中叶,门捷列夫的突出贡献是
A 提出原子学说 B 发现元素周期律
C 提出分子学说 D 最早发现了氧气
2.碳的三种同位素![]() 、
、![]() 、
、![]() 的原子,下列各项对三种原子均不同的是
的原子,下列各项对三种原子均不同的是
A 核电荷数 B 中子数 C 电子层数 D 元素种类
3.下列各组元素中,原子半径依次增大的是
A I, Br, Cl B O, S, Na C Al, Si, P D C, N, B
4.下列物质中含有极性共价键的是
A 单质碘 B 氯化镁 C 溴化钾 D 水
5.在单质的晶体中,一定不存在
A 离子键 B 分子间作用力
C 共价键 D 金属离子与自由电子间的作用
6.下列各组物质中,化学键类型相同,晶体类型也相同的是
A 金刚石和CO2 B NaBr和HBr C CH4和H2O D Cl2和KCl
7.共价键、离子键和范德华力是构成物质微粒间的不同作用,下列物质中只含有上述一种作用的是
A 干冰 B 氯化钠 C 氢氧化钠 D 碘
8.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是
A Na2O和SiO2熔化 B Mg和S熔化
C 氯化钠和蔗糖熔化 D 碘和干冰升华
9.已知x、y、z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应水化物酸性依次增强,则下列判断正确的是
A 原子半径按x、y、z顺序增大 B 阴离子的还原性按x、y、z顺序增强
C 单质的氧化性按x、y、z顺序增强 D 氢化物的稳定性按x、y、z顺序减弱
10.x和y两元素的阳离子具有相同的电子层结构,x元素的阳离子半径大于y元素的阳离子半径;z和y两元素的原子核外电子层数相同,z元素的原子半径小于y A x+2 B x+4 C x+8 D x+18
元素的原子半径,x、y、z,3种元素原子序数的关系是
A x>y>z B y>x>z C z>x>y D z>y>x
11.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A . x+8 B. x+18 C. x+32 D. x+36
12.据报道:一个国际科学家小组利用加速器把锌原子加速,并在数星期内不断撞击一张铅箔从而得到质量数为277的112号新元素,其元素符号用Uub表示,阅读此报道,回答①—②题.
①该Uub原子核内中子数是
A 112 B 165 C 277 D 389
②比277Uub原子核少75个质子和117个中子的原子,在元素周期表的位置是
A 第3周期第VIIA族 B 第4周期和IA族
C 第5周期第IA族 D 第4周期第VIII族
13.氰(CN)2、硫氰(SCN)2、氧氰(OCN)2的性质相似,在化学上称为拟卤素,CN-、SCN-、OCN-的性质与卤素离子相似,已知:不同卤素原子能组成卤素互化物,如IBr。HSCN为强酸,HClO、HCN为弱酸,试回答下列问题:
![]() ①下列物质的电子式错误的是
①下列物质的电子式错误的是
![]()
②已知(OCN)2的电子式为 则SCN-的电子式正确的是
![]()
14.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”,已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,则![]() 原子个数比应为
原子个数比应为
A 61:39 B 30:61 C 1:1 D 39:11
15.若短周期的两元素可形成原子个数比为2:3的化合物,则这两种元素的序数的之差不可能是
A 1 B 3 C 5 D 6
16.据报道,有科学家用激光将置于铁室内石墨靶上的碳原子炸松,与此同时,再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜,据称,这种化合物可能比金刚石更坚硬,其原因可能是
A 碳、氮原子构成网状结构的晶体
B 碳氮键比金刚石中碳碳键更短
C 氮原子最外层电子数比碳原子最外层电子数多
 D 碳、氮的单质化学性质均不活泼
D 碳、氮的单质化学性质均不活泼
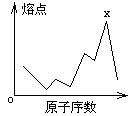
17.原子序数小于18的八种连号元素,它们的单质
熔点随原子序数增大而变化的趋势如图所示,
图中x元素应属
A IIIA族 B IVA族
C VA族 D VIA族
18.下列各组物质的熔沸点由高到低的顺序正确的是
A 石墨、金刚石、晶体硅、碳化硅 B CF4、CCl4、CBr4、CI4
C MgCl2、NaCl、KCl、CsCl D Na、Li、K、Rb、Cs
19.可逆反应:2SO2+O2![]() 2SO3,如果SO2的起始浓度为2mol/L,2min后, SO2浓度为1.8 mol/L,则用SO2的浓度变化表示的反应速率为
2SO3,如果SO2的起始浓度为2mol/L,2min后, SO2浓度为1.8 mol/L,则用SO2的浓度变化表示的反应速率为
A 1mol/(L·min) B 0.9 mol/(L·min)
C 0.2 mol/(L·min) D 0.1 mol/(L·min)
20.在一定条件下,反应2A(气)+2B(气)![]() 3C(气)+D(气)达到平衡状态的标志是
3C(气)+D(气)达到平衡状态的标志是
A 单位时间内生成2n mol A, 同时生成n mol D
B 容器内的压强不随时间变化
C 单位时间内生成n mol B,同时消耗1.5n mol C
D 容器内混合气体密度不随时间而变化
21.氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子数之比为3:1,则相对分子质量为70、72、74的氯气分子数之比可能是
A 5:2:1 B 5:2:2 C 9:3:1 D 9:3:2
22.x和y是原子序数大于4的短周期元素,xm+和yn-两种离子的核外电子排布相同,下列说法中正确的是
A x的原子半径比y的原子半径小 B x和y的核电荷数之差为m-n
C y原子核内所含质子数比x多 D x和y的族序数之差为8-m-n
23.下列说法中不正确的是
A HCl溶于水的过程中,共价键被破坏
B 离子化合物中一定含有离子键,可能含有共价键
C 含金属元素的离子一定都是阳离子
D 含非极性键的化合物一定是共价化合物
24.下列说法正确的是
A 可逆反应的特征是正反应速率总是和逆反应速率相等
B 在其他条件不变时,使用催化剂能改变反应速率和化学平衡状态
C 在其他条件不变时,升高温度,可以使化学平衡向吸热方向移动
D 在其他条件不变时,增大压强,一定会破坏气体反应的平衡状态
25.X、Y两种元素原子的电子层数均小于或等于3。已知aXn比bYm多两个电子层。下列判断正确的是
A X原子只能有三个电子层 B b≤5
C a+n-b+m=10或16 D Y原子不可能有两个电子层
二.填空题(共40分)
26.(4分)下表列出了钠的卤化物(NaX)和硅的卤化物(SiX4)熔点:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.5 |
从表中可以看出,钠的卤化物熔点比相应的硅的卤化物的熔点高得多,请用所学知识
简单解释.
27.(10分)现有八种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化
钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖,请用编号填写下列空白:
⑴通过非极性键形成原子晶体是 .
⑵固态时属于分子晶体的是 .
⑶属于分子晶体,且分子为直线型的是 .
⑷由单原子分子构成的分子晶体是 .
⑸含有非极性键的离子化合物是 .
28.(4分)对晶体结构图形的观察,应有三维空间的认识,
如右图是高温超领域中的一种化合物钙——钛矿(氧化物)晶体
结构中具有代表性的最小重复单元,
⑴在该晶体中每个钛离子周围与它最近且等距离的钛离子
有几个?
⑵该晶体中氧、钙、钛的微粒个数比是多少?
29.(6分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素,
| B | ||||||||||||||||||
| h | j | |||||||||||||||||
| A | c | f | i | l | m | |||||||||||||
| e | g | |||||||||||||||||
| d | k | |||||||||||||||||
⑴下列 (填写编号)组元素的单质可能都是电的良导体
①a, c, h ②b, g, k ③c, h, l ④d, e, f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去,核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2. 形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1);
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 .
②表中x可能为以上13种元素中的 (填写字母)元素,用元素符号表示x和j形成化合物的化学式 .
③y是周期表中 族元素.
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多.
30.(11分)在元素周期表1——18号元素中,A元素的单质能与水剧烈反应放出气体,A成为稳定的气态氢化物;B元素的气态氢化物溶于水,溶液呈碱性;C元素阳离子与A元素的阴离子电子层结构相同,0.1mol C单质与足量盐酸反应,生成的H2在标准状况下体积为3.36L;D元素的原子序数等于B元素原子序数的2倍.
⑴A、B、C、D的元素符号分别是 , , , .
⑵用电子式表示B的气态氢化物的形成过程: .
⑶写出在可溶性C盐溶液中逐滴加入氢氧化钠溶液直至过量的离子方程式: .
⑷A单质的氧化性比B单质 ,C单质的还原性比D单质 .(填“强”或“弱”)
⑸上述非金属元素形成的气态氢化物分子中属于非极性分子的是 .(写结构式)
31.A、B、C是短周期IA和IIA族元素的碳酸盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。已知:mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
⑴写出短周期IA和IIA族元素形成的所有碳酸盐的名称:
⑵若以MA、MB、MC分别表示A、B、C的相对分子质量,试写出MA、MB、MC三者的相互关系式 .
⑶A的正确选择有 种,其化学式为 .
⑷若A和B为IIA族元素的碳酸盐,C为IA族元素的碳酸盐,则A、B、C的化学式依次是 .
三.计算题(6分)
32.食盐晶体是由钠离子,且均匀等距离的
钠离子(图中的“●”)和氯离子,(图中的“O”)
组成的,且均匀等距离的交错排列,已知食盐的
密度是2.2g/cm3, 阿伏加德罗常数为6.02×1023mol-1,
求食盐晶体中两个距离最近的钠离子中心间的距离?
附加题(5分)
1.中学教材上图示NaCl晶体结构,它向三维空间延伸得到完美晶体,NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与其最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)
2.天然的和绝大部分人工制备的晶体都
存在各种缺陷,例如在某种NiO晶体中就存在
如图所示的缺陷:一个Ni2+空缺,另有两个
Ni2+被Ni3+所取代,其结构晶体仍呈电中性,
但化合物中Ni和O的比值却发生了变化,
某氧化镍样品组成为Ni0.97O,试计算该晶体
中Ni3+和Ni2+的离子数之比.