江西省清江中学05-06学年度第二学期高一期中化学试卷
06-04-10
可能用到的相对原子质量:
H 1 He 4 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Ag 108 Ba 137
一、选择题
1.下列属于同位素的一组是( )
A.N2和N2 O B.Na2O和Na2O2 C.氕、氘、氚 D.40K、40Ca
2.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
3.某元素最高价氧化物对应的水化物的分子式是H4RO4,则其气态氢化物的分子式是( )
A.RH4 B.RH3 C.H2R D.HR
4.已知硼化物BxHyz-与B10C2H12的电子总数相同,则BxHyz-的正确表达式为( )
A.B9H152- B.B10H142- C.B11H132- D.B12H122-
5.下列材料最不宜用作储存浓H2SO4的容器是( )
A.铁 B.氧化铝 C.铝 D.玻璃
6.将SO2通到显红色的酚酞试剂中,发现红色消失,主要是因为SO2( )
A.有漂白性 B.有还原性 C.溶于水后显酸性 D.有氧化性
7.化学研究中,只有了解物质的结构,才能深刻地认识它们的性质和变化规律。下列关于物质结构说法正确是 ( )
A.失电子难的原子获得电子的能力不一定强
B.冰是由氢原子和氧原子直接构成的
C.原子及其离子的核外电子层数等于该元素所在的周期数
D.M层电子为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等
8.下列各组物质按照碱性递减顺序排列的是( )
A.LiOH、NaOH、CsOH B.Ba(OH)2、Ca(OH)2、Mg(OH)2
C.Ca(OH)2、KOH、Ba(OH)2 D.Al(OH)3、Mg(OH)2、NaOH
9.硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则对10B的质量分数判断正确的是( )
A.20% B.略大于20% C.略小于20% D.80%
10.某元素的一种原子核内质子数为m,中子数为n,则下述论断中正确的是( )
A.不能确定该元素的原子量
B.这种元素的原子量为(m + n)
C.若碳原子的质量为w克,此原子的质量为(m + n)w克
D.核内中子的总质量小于质子的总质量
11.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A..1C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
12.科学家最近研制出核电荷数为112的新元素,其原子的质量数为277,下列关于该新元素的叙述中正确的是( )
A.其原子核内质子数和中子数均为112
B.其原子核内中子数为165,核外电子总数为112
C.其原子的质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277∶112
13.为检验Na2SO3溶液中是否有Na2SO4,使用的试液是( )
A.BaCl2溶液 B.BaCl2 和稀HNO3 C.BaCl2和H2SO4 D.BaCl2和稀HCl
14.下列离子方程式书写正确的是:( )
A.2Fe2性溶液中加入双氧水 2Fe2++H2O2+2H+==2Fe3++2H2O
B.漂白粉溶液中通入少量二氧化硫气体Ca2++2ClO—+SO2+H2O==CaSO3↓+2HClO
C.酸钡中加入稀硫酸 BaCO3+2H+==Ba2++CO2↑+2H2O
D.Na2SO4溶液中加入少量Ba(OH)2溶液:SO42— + Ba2+ = BaSO4↓
15.下列物质能使品红溶液褪色的是( )
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
A. ②③④⑤ B. ①②③ C. ①④⑤ D. 全都可以
16.下列各组粒子,电子数和质子数分别相同的是( )
A.K+和Br- B.Na+和F- C.H2O和H2S D.OH- 和NH2-
17.由短周期元素形成的化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,下列说法正确是( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数不相等
C.A是第二周期;第IIIA族的元素 D.B是第三周期VIA族的元素
18.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A. n=m+16 B. n=m+6 C. n=m+30 D. n=m+10
19.下列离子方程式不正确的是( )
A.H2S气体通入足量的NaOH溶液中: H2S+OH—=HS—+2H2O
B.过量的CO2通入澄清石灰水:CO2+OH—=HCO3—
C.Al2O3与盐酸的反应:Al2O3+6H+=2Al3++3H2O
D.碳酸钡中滴加稀硫酸:BaCO3+2H+ = BaSO4↓+CO2↑+H2O
20.氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A、NaH在水中显酸性 B、NaH中氢离子电子排布与氦原子相同
C、NaH中氢离子半径比锂离子的小 D、NaH中氢离子可以被还原成氢气
二、非选择题
21.(6分)GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于元素周期表的第ⅢA族,As位于周期表的第VA族。
(1)Ga和As的最外层电子数分别是__________,_____________
(2)GaAs中Ga和As的化合价分别是__________,_____________
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料(属于无机非金属材料),该化合物半导体材料的化学式可表示为__ ____。
22.(6分)在元素周期表短周期中,最活泼的金属元素为 ,最活泼的非金属元素为 ,最外层电子数是次外层电子数2倍的元素是 。(以上用元素名称回答)最高价氧化物水化物酸性最强的酸,其分子式 是 ,电子总数为10的氢化物有 。
23.(10分)有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的式量与X最高价氧化物的式量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne的相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 ;X与Y形成的离子化合物的电子式为 ,Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与CO2反应的化学方程式为
24.(6分)AB2离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54摩电子,根据下列反应:①H2+B2 →C ②B2+X →Y+AB2+H2O ③Y+C → AB2+Z Z有漂白作用
(1)写出下列物质的化学式:AB2____________X_________Y_________Z________
(2)用电子式表示AB2的形成过程
(3)写出反应②的化学方程式_____________________________________________。
25.(12分)根据下图回答问题:
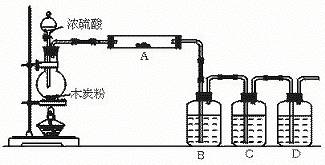
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单方法证明装置不漏气。
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
__________________________________________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是_______;作用是___________________。B中加入的试剂是______;作用是_______________________。C中加入的试剂是_______;作用是除尽____________气体。
D中加入的试剂是______;作用是_______________________。
(4)实验时,C中应观察到的现象是_________________ __ ______________。
26.(10分)将2.000 g Na2SO4、Na2CO3和NaNO3的混合物溶于水得溶液A,在A中加入足量未知浓度的BaCl2溶液10.00 mL,然后过滤得沉淀B3.315g和滤液C;在C中加入足量的AgNO3溶液,又生成5.740 g沉淀;向B中加入足量稀硫酸,充分反应后,沉淀质量变为3.495g。计算:
⑴氯化钡溶液的物质的量浓度。
⑵原混合物中硝酸钠的质量分数。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| C | D | A | B | D | C | A | B | C | A | C |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | ||
| B | D | A | D | D | D | D | A | B |
21.(1) 3,5 (2)+3;-3 (3) SiC
22.钠,氟,碳,HClO4; CH4,NH3,H2O,HF
23.(1)S,Na,Cl
(2)略 (3)2Na + O2![]() Na2O2,2Na2O2 +
2CO2 = 2 Na2CO3
+ O2
Na2O2,2Na2O2 +
2CO2 = 2 Na2CO3
+ O2
24.(1)CaCl2 Ca(OH)2 Ca (ClO)2 HClO(2)
(3)2Cl2+2 Ca(OH)2=== CaCl2+ Ca (ClO)2+ 2H2O
25.(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不 漏气。
(2)2 H2SO4(浓)+C ===2H2O+2SO2↑+CO2↑
(3) A:无水硫酸铜 检验H2O B:品红溶液 检验SO2
C:酸性高锰酸钾溶液 检验SO2 D:澄清石灰水 检验CO2
(4)酸性KMnO4 溶液的颜色不褪尽(或不褪色,或不褪成无色)。
26.⑴n(Cl—)=![]() =0.04 mol
=0.04 mol
c(BaCl2) = 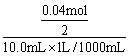 = 2.0 mol/L
= 2.0 mol/L
⑵Na2CO3 ~ BaCO3 ~ BaSO4 Δ m
1mol 197 g 233 g 36g
n(Na2CO3) =(3.495g-3.315g)÷36g·mol—1 = 0.005mol
n(Na2SO4) = (3.315g-0.005mol×197 g·mol—1) ÷233 g·mol—1= 0.01mol
m(NaNO3)=2.000g-0.005mol×106 g·mol—1- 0.01mol×142 g·mol—1= 0.05g
w(NaNO3)=0.050g÷2.000g=0.025(2.5%)