第五单元《物质结构 元素周期律》测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。时间:100分钟。
第Ⅰ卷(选择题 共72分)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32 Cl—35.5 K—39 Ca—40 Fe—56 Ba—137
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.提出元素周期律并绘制了第一个元素周期表的科学家是
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿 ( )
2.下列电子式书写错误的是 ( )
![]() A.∶‥‥∶C∶‥‥∶
B.
A.∶‥‥∶C∶‥‥∶
B.
C. [∶‥‥∶H]- D.Na+[∶‥‥∶‥‥∶]2-Na+
3.科学家把不同原子核称为不同核素。我国科学家在世界上首次合成了三种新核素,其中一种新核素的名称是铪-185,符号185Hf,下列关于铪-185的叙述,不正确的是
A.它是一种新的原子 B.它是一种新的元素 ( )
C.它的质量数为185 D.它是铪-180的一种新的同位素
4.下列晶体,其中任何一个原子都被相邻的4个原子包围,以共价键形成
正四面体结构,并向空中伸展形成网状结构的是 ( )
A.甲烷 B.石墨 C.晶体硅 D.水晶
5.下列说法正确的是 ( )
A.在周期表中,族序数都等于该族元素的最外层电子数
B.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C.同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大
D.碱金属随原子序数的增大,其熔沸点逐渐降低;卤素单质随原子序数的增大,其熔沸
点逐渐升高
6.关于同温同压下等体积的CO2和CO叙述:①质量相等,②密度相等,③所含分子数相等,④所含碳原子个数相等,其中正确的是 ( )
A.①②③④ B.②③④ C.③④ D.③
7.已知A为ⅡA族,B为ⅢA族,它们的原子序数分别为m、n, 且A和B为同一周期元素。下列关系式错误的是 ( )
A.n=m+1 B.n=m+11 C.n=m+25 D.n=m+10
8.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温度物质。下列各组物质熔化时,所克服的微粒间作用与氮化硼熔化所克服的微粒间作用都相同的是
A.硝酸钠和金刚石 B.晶体硅和水晶 ( )
C.冰和干冰 D.苯和萘
二、选择题(本题包括8小题,每小题5分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是 ( )
A.原子晶体干冰有很高的熔点、沸点,有很大的硬度
B.原子晶体干冰易气化,可用作制冷材料
C.原子晶体干冰硬度大,可用作耐磨材料
D.每摩尔原子晶体干冰中含2molC-O键
10.若某氖原子的质量是ag,12C原子的质量是bg,NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.氖元素的原子量一定是 12a / b
B.该氖原子的摩尔质量是aNA g / mol
C.Wg该氖原子的物质的量一定是 w /(aNA) mol
D.Wg该氖原子所含质子数是10w / a
11.下列各指定微粒的数目之比不是1∶1的是 ( )
A.Na2O2晶体中阴离子和阳离子 B.NaHCO3晶体中的钠离子和碳酸氢根离子
C.2412Mg2+离子中的质子和中子 D.氯化铵溶液中的铵根离子和氯离子
12.同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是
HXO4>H2YO4>H3ZO4,则下列判断中错误的是 ( )
A.原子半径X>Y>Z B.非金属性X>Y>Z
C.气态氢化物的稳定性HX>H2Y>H3Z D.阴离子的还原性X->Y2-> Z3-
13.第7周期为不完全周期,若将来的发现把这一周期元素全部填满,则下列有关第7周期元素的推论可能正确的是 ( )
A.第7周期排满时有32种元素,全部是放射性元素
B.第7周期排满时最后一种元素的单质不与任何物质发生化学反应
C.第7周期第ⅦA族元素的原子序数为117, 是一种非金属元素
D.第7周期第ⅢA族元素的氢氧化物与氢氧化铝具有相似的化学性质
14.X、Y为元素周期表中处于相邻周期的两元素,它们原子核内质子
数之和为21,Y原子的核外电子数比X原子的核外电子数多5个,试判断下
列描述正确的是 ( )
A.X元素的原子易形成由非极性键结合组成的X单质的分子
B.X元素的单质是一种原子晶体
C.由这两种元素构成的一种阴离子与稀盐酸反应可能转化为Y的一种阳离子
D.X元素跟硫元素只能构成一种由极性键结合的化合物
15.资料上记载的氯元素有关的数据摘录如下,下列说法中不正确的是
| 35 Cl | 34.969 | 75.77% | 35 Cl | 35 | 75.77% |
| 37 Cl | 36.962 | 24.23% | 37 Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
A.35.485表示氯元素的近似原子量 ( )
B.24.23%表示自然界中37Cl的质量百分含量
C.35.453表示氯元素的原子量
D.35表示同位素的质量数
16.英国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家确认世界上还存在着另一种“分子足球”N60,它与C60的结构相似,并且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法中正确的是 ( )
A.N60是由共价键构成的网状结构晶体,属于原子晶体
B.N60与14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界的新天地,将来会成为最好的火箭燃料
第五单元《物质结构 元素周期律》测试题
班级 学号 姓名 得分
选择题一、二答题卡(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共78分)
三、填空题(本题包括6小题,共58分)
17.(6分)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形。如果5个N结合都达到8个电子结构,且含有2个N![]() N叁键,则“N5”分子碎片所带电荷是 ,写出它的电子式
。
N叁键,则“N5”分子碎片所带电荷是 ,写出它的电子式
。
18.(8分)已知有关物质的熔、沸点数据如右表:
请参考上述数据填空和回答问题:
|
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?
答:
。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是:
答:
。
19.(9分)有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素。金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸。E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个。
⑴写出A元素名称:____________,C2粒子的符号:________ ___。
⑵画出E离子的结构示意图:________________,E的氢化物的分子式_________________。
⑶写出B与E化合的化学方程式:________________________。
⑷写出A的单质、 B的单质分别与水反应的溶液混合后发生的反应的离子方程式:___________________________________________。
⑸A与C形成的化合物中含化学键类型是:___________,用电子式表示该化合物:___________________。
20.(9分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴ 通过分析x值变化规律,确定N.Mg的x值范围:
< x(Mg) < ; < x(N) < 。
⑵ 推测x值与原子半径关系是 。
根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
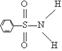
⑶ 某有机化合物结构式为 ,其中S—N中,你认为共用电子对偏向谁?
(写原子名称)。
⑷ 经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx < 1.7,一般为共价键,试推断:AlCl3中化学键类型是 。
⑸ 预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
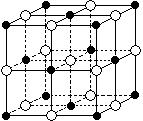
21.(12分)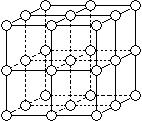 如图所示,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
如图所示,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有 个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于 ,即(填计算式) ;Na+的个数等于 ,即(填计算式) 。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρg·cm-3,阿伏加德罗常数为NA 。食盐晶体中两个距离最近的钠离子中心间的距离为 cm。
22.(15分)如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
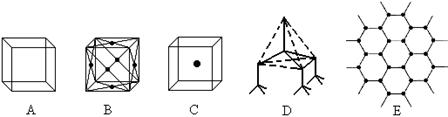
(1)其中代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等。金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子平均为 个。
(3)其中代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个。
(4)代表CsCl的是 ,它属于 晶体,每个Cs+与 个Cl-紧邻。
(5)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为 。
四、计算题(本题包括2小题,共20分)
23.(8分)⑴电解含重水(D2O)的普通水,当电路中有4moL电子通过时,测得两惰性电极上共产生36.5克气体。则在生成的气体中1H和2H的质量比为_ _。
⑵Na+与35Cl-、37Cl-(氯元素的原子量为35.5)构成的5.85克NaCl中,含37Cl的NaCl的质量为________。
24.(12分)AxByCz是由A、B、C三种处于不同短周期元素组成的化合物。已知:
(1)x、y、z均为整数,且x+y+z=13;(2)取0.05mol该化合物与过量的水反应产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既能溶于NaOH溶液,又能溶于盐酸;
(3)同温同压下,20mL由B、C两种元素组成的M气体,完全燃烧需要40mL氧气,燃烧产物为二氧化碳和水。通过计算和推理可知,三种元素的名称分别是A________、B________、C________,气体M的化学式是________,AxByCz的化学式是________,AxByCz与水反应的化学方程式为_______________________________________。
第五单元《物质结构 元素周期律》测试题参考答案
一、选择题(每小题4分) 二、选择题(每小题5分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | A | B | C | D | D | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | A | AD | AD | A | AC | D | D |
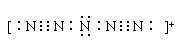 三、填空题(本题包括6小题,共58分)
三、填空题(本题包括6小题,共58分)
17.(4分)+1价
18.(6分)(1)MgO的熔点远高于MgCl2,电解质熔融MgO将需要更高的温度,消耗更多的能源;AlCl3属于分子晶体,熔融时不能导电,不能被电解。(2)将两种晶体加热到熔化状态,测其导电性,MgCl2能导电,AlCl3不能导电。
![]() 19.(9分)⑴A:氟;C2:
19.(9分)⑴A:氟;C2:![]() H
H
⑵E离子: , E的氢化物的分子式:H2O
⑶ 4Na+O2═2Na2O 2Na+O2 Na2O2
![]() ⑷HF+OH-═F-+H2O
⑷HF+OH-═F-+H2O
⑸共价键,HF的电子式:
20.(10分)⑴0.93<x(Mg)<1.61 2.25<x(N)<3.44 ⑵同周期(同主族)中,x值越大,其原子半径越小(2分); 周期性。 ⑶氮原子 ⑷共价键 ⑸第六周期第ⅠA族(铯)
21.(12分)(1)见图 (2)12
 (3)4 8×+6×=4 4 12×+1=4(4分)
(3)4 8×+6×=4 4 12×+1=4(4分)
(4)设晶胞的边长为a cm,1mol晶胞中含4mol NaCl。
则NA·a3= a =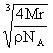 cm
cm
∴rNa+-Na+ =![]() ×=
×=![]()
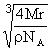 cm(4分)
cm(4分)
四、计算题(本题包括2小题,共20分)
22.(15分)(1)D;3;原子 (2)E;2 (3)A;12 (4)C;离子;8
(5)B;分子;12 (6)石墨>金刚石>NaCl>CsCl>干冰(2分)。
23.(8分)⑴ 2H2O 2H2↑ + O2↑ 电子转移数
2mol 1mol 4mol
m(H2)= 36.5-1×32=4.5
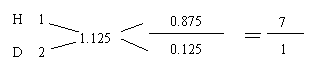 H2的平均分子量:
H2的平均分子量:![]() =2.25 H的平均分子量:1.125
=2.25 H的平均分子量:1.125
生成的气体中1H和2H的质量比:7:1×2=7:2
⑵n(NaCl)=![]() =0.1mol,故Cl-为0.1mol
=0.1mol,故Cl-为0.1mol
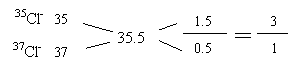 |
其中37Cl-为![]() =0.025mol,它与Na+构成的Na37Cl的质量为:
=0.025mol,它与Na+构成的Na37Cl的质量为:
0.025×(23+37)=1.5
24.(12分)由已知(3)可知M为烃,设其分子式为CaHb;且1mol烃与2molO2恰好反应生成CO2和H2O,即:CaHb+2O2→2H2O+CO2,则a=1,b=4,M为CH4。2.4gCH4为0.15mol,由已知(2)可知1molAxCyHz生成3molCH4和1molA的两性氢氧化物,则x=1,y=3,由已知(1)1+3+z=13,则z=9。所以AxByCz化学式为AlC3H9。A是Al,B是C,C是H,M的化学式是CH4,AxByCz化学式是AlC3H9,AlC3H9+3H2O=3CH4↑+Al(OH)3↓