高一化学元素周期表同步练习
一、选择题(每小题只有1个符合题意的选项)
1、除一周期外,关于同周期主族元素的下列变化规律叙述中不正确的是( )
A、从左到右,原子半径逐渐减小。
B、从左到右,元素原子的氧化性减弱,还原性增强。
C、从左到右,元素最高正价数从1递增到7,负价由-4递变到-1
D、从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强。
2、主族元素,在周期表的位置,取决于元素原子的( )
A、相对原子质量和核电荷数。
B、电子层数和质子数。
C、电子层数和最外层电子数。
D、金属性和非金属的强弱。
3、甲、乙是周期表中同主族 的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A、х+2 B、 х+4 C、х+8 D、х+18
4、已知甲元素原子的最外层电子数是次外层电子数的3倍,乙元素原子的次外层电子数是最外层电子数的2倍,则甲、乙元素 ( )
A、是同周期元素。 B、都是同主族元素。
C、是不同周期不同族的金属元素。 D、是不同周期不同族的非金属元素。
5、在周期表中,金属和非金属分界线附近能找到( )
A、制农药的元素。 B、制半导体的元素。
C、作催化剂的元素。 D、制耐高温合金材料的元素。
6、同主族周期数递增的X、Y、Z三元素,已知它们最高价氧化物对应水化物的酸性依次减弱。下列判断中不正确的是( )
A、元素原子半径递增。 B、元素氧化性递增。
C、气态氧化物稳定性递减。 D、气态氧化物还原性递增。
7、原子序数为а的元素х位于周期表的第ⅡA族,与x同周期的第ⅢA族元素y的原子序数不可能为( )
A、а+1 B、а+8 C、а+11 D、а+25
8、短周期元素的三种粒子![]() 电子层结构相同,下列分析中正确的是( )
电子层结构相同,下列分析中正确的是( )
A、原子序数a>b>c B、原子半径:ry>rx
C、![]() D、Z一定是稀有气体中的氩元素
D、Z一定是稀有气体中的氩元素
9、短周期元素X、Y、Z的位置如下图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍。X、Y、Z三元素的元素符号是( )
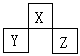
A、N、Si、S B、O、P、C1
C、F、S、Ar D、C、A1、P
10、氯元素有两种天然同位素,35C1、37C1,其中原子数之比约为3:1,则由这两种同位素原子形成三种氯元素单质分子物质的量之比约为( )
A、9:6:1 B、6:6:1 C、3:2:1 D、1:3:2
二、填空
11、在课本使用的元素周期表中,已发现的非金属元素共有 种;若发现新元素,将七周期填满有,试预测,非金属将增加到 种;若发现了117号元素,试预测它是 (从“金属”或“非金属”中选填)。在非金属元素中,除H、O、F外,最高正价与最低负价的绝对值之差分别为0、2、4、6时,这些元素所在族序数是 。
12、下表是元素周期表的一部分:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O | |
| 2 | F | H | |||||||
| 3 | B | A | C | E | G |
根据A~H在周期表的位置回答下列问题:
(1)在上述8种元素形成的化合物中,最高价氧化物对应水化物酸性最强的是 ;气态氢化物稳定性最差的是 。
(2)写出B单质与水反应的离子方程式 ;A单质与热水反应的化学方程式 ;C的最高价氧化物对应水化物分别与盐酸和NaOH溶液反应的离子方程式是 。
13、A、B、C、D四种元素,已知A元素所处周期数,族序数和原子序数相等;B是能形成含氧酸的元素中原子半径最小,C原子M层电子数是K层电子数的3倍,D的+1价阳离子与C的阴离子电子层结构相同。回答以下问题:
(1)A、B、C、D四种元素的号符分别是
(2)C、D离子的结构示意图是 、
(3)比较C、D两元素最高价氧化物对应水化物的酸碱性强弱,因为:
所以:
参考答案:
一、选择题
1、B 2、C 3、B 4、D 5、B 6、B 7、B 8、B
9、B 10、A
二、填空题
11、22;23;金属;ⅣA、ⅤA、ⅥA、ⅦA 12、(1)HC1O4;PH3
(2)2Na+2H2O=2Na+ +2OH- +H2↑;![]()
A1(OH)3+3H+=A13+ +3H2O;A1(OH)3+OH-=A1O2- +2H2O。
13、(1)H、N、S、K
(2)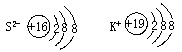
(3)
![]()