高一级化学科第二学期期中考试
试卷
考试时间:120分钟 满分:150分
甲卷(100分)
可能用到的相对原子质量:Na:23 H: 1 O:16 S:32 Fe: 56 Cu:64 Zn:65
一、选择题:(每小题只有一个正确答案,每小题4分,共32分)
1. 下列各组中,属于同位素的是:
A.H2、D2、T2 B.金刚石和石墨 C.H2O和D2O D.![]() 、
、![]() 和
和![]()
2. 下列反应产生的气体,通过Na2SO3溶液而不反应的是
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④Na2O2和H2O
⑤铜片和浓硫酸共热
A.①② B.② C.①②⑤ D.全部反应
3. 下列物质中含有非极性键的化合物是
A.NaOH B.Na2O2
C.Cl2 D.CO2
4. 下列各组指定原子序数的元素,不能形成AB2型化合物的是
A.6和8 B.16和8 C.11和6 D.12和9
5. 现在含有元素硒(Se)的保健品已开始进入市场。已知它与氧同族,与钾同周期。则下列关于硒的叙述中,不正确的是
A. 气态氢化物的化学式为H2Se B. 最高价氧化物的化学式是SeO3
C. 硒是半导体 D.非金属性比硫强
6. 主族元素A有1个价电子,主族元素B的最高价与最低价的绝对值相等,它们形成化合物的化学式是
A. AB3 B. BA4 C. A2B D. B2A3
7. 下列各微粒中, 核外电子总数相等的是
A. Na和Na+ B. N2 和 CO2
C. NH4+ 和 H3O+ D. H2S 和 H2O
8. 为了保护臭氧层,可行的有效措施是:
A. 减少二氧化硫的排放量 B. 减少含铅废气的排放量
C. 减少氟氯烃的排放量 D.减少二氧化碳的排放量
二、选择题(每小题有一个或两个选项符合题意。每小题4分,共32分。正确答案只有一个选项的,多选或错选给0分;正确答案有两个选项的,只要选错一个就给0分,只选了一个且为正确的给2分)
9. VCD光盘上的记录材料有很多种,他们都可能在激光的照射下发生化学或物理性能的改变从而记录信号。碲(Te)的化合物是常用的VCD光记录材料的一种,对碲元素及其化合物的下列认识,不正确的是
A.Te元素位于元素周期表中第五周期第Ⅵ族 B.H2TeO4的酸性比HBrO4强
C.碲化氢的化学式是H2Te D.单质碲在常温下是固体
10. 向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.45摩
B.等于0.45摩
C.在0.45摩与0.90摩之间
D.大于0.90摩
11. 下列叙述正确的是
A.同主族金属的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.Br2蒸汽被木炭吸附时共价键没有被破坏
D.同周期元素的原子半径越小越易失去电子
12.既能与盐酸反应,又能与氢氧化钠溶液反应的是:
A.Al2O3 B.Na2CO3 C.Al(OH)3 D.AlCl3
13.下列不能用浓硫酸来干燥的气体是
A.HCl B.HI C.SO2 D.NH3
14. X、Y、Z和R分别代表四种元素。如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
15.相同浓度、相同体积的稀硫酸与足量的下列物质反应,所得溶液的物质的量的浓度最大的是
A.Zn B.ZnO C.Zn(OH)2 D.ZnCO3
16.下列哪些事实是由于氯的非金属性比硫强的结果
A.次氯酸的酸性比硫酸弱
B.氯能置换硫化氢中的硫
C.硫与铁反应生成硫化亚铁而氯与铁反应生成氯化铁
D.硫能在空气中燃烧,而氯则不能
三、填空题(每空2分共20分)
17. 汽车尾气(含有碳氢化合物、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(铂、钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气生态循环的无毒气体,并促使碳氢化合物充分燃烧用SO2的转化。
(1)写出CO和NO反应的化学方程式_______________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是_______________。
(3)控制城市空气的污染源的方法可以有______
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
18. 元素的种类决定于________________ , 元素的化学性质主要决定于_________________________.在原子序数为 1 — 18 号的元素中酸性最强的含氧酸是 _________,气态氢化物最稳定的是 __________。
19. A、B、C、D都是短周期的元素。A元素的原子核外有2个电子层,最外层已达到饱和。B元素位于A元素的下一周期,最外层的电子数是A元素最外层电子数的1/2。C元素的离子带有两个单位正电荷,它的核外电子排布与A原子相同。D元素与C元素属同一周期,D元素原子的最外层电子数比A的最外电子数少1。
根椐上述事实判断:
C是 D是 (填元素符号)
B元素在周期表中的位置中 ,
四、实验题(8分)
20. 实验室乙醇与浓硫酸反应制乙烯,常因温度过高而使烧瓶中液体变黑。为了验证被硫酸氧化确实有二氧化碳气体生成,某同学设计如图所示的A、B、C三个装置进行实验(乙醇与浓硫酸的反应装置省略,并假设装置C中的反应完全)。请回答:
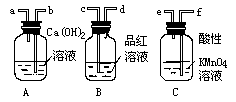
(1)装置B的作用是_______;(2分)
(2)三个装置之间的连接顺序是(填写导管口序号a、b、c、d、e、f)(3分):
气体发生装置导管口接_______,然后_______接_______,_______接______;
(3)装置A、B、C中各有什么现象?(3分)
A中______,B中_______,C中_______;
五、计算题
21. (8分)含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,问生产98 %的硫酸1吨,需黄铁矿多少吨
乙卷(50分)
一、选择题(每小题有一个或两个选项符合题意。每小题4分,共24分。正确答案只有一个选项的,多选或错选给0分;正确答案有两个选项的,只要选错一个就给0分,只选了一个且为正确的给2分)
1. 某元素的原子最外层有 2 个电子, 该元素( )
A.一定是金属元素 B.最高化合价一定为 +2 价
C.一定是 ⅡA 族元素或是 He D.无法确定属于哪类元素
2.下列反应中,不能产生黑色固体的是( )
A.铜在硫蒸气中燃烧 B.铁丝在氧气中燃烧
C.氯气与硫化氢气体混和 D.氯化锌溶液与硫化钠溶液混和
3.某Na2SO3样品已部分被氧化为Na2SO4,经测定该混和物中含硫25%,则混和物中Na2SO3与Na2SO4的物质的量之比为( )
A.7:6 B.6:7 C. 7:1 D. 1:7
4.下列比较正确的是( )
A.原子半径:Na>K B.价电子数:P>S>Cl
C.最高正价:Se<Te D.离子半径:S2—>Cl—>K+
5.为方便某些化学计算,有人将98%的浓H2SO4表示成下列形式,其中合理的是( )
A. H2SO4·![]() H2O
B. H2SO4·H2O
H2O
B. H2SO4·H2O
C. H2SO4·SO3
D. SO3·![]() H2O
H2O
6.元素周期表中第 m 号元素, 其原子的质量数为 n , 关于该元素的下列叙述中正确的是( )
A. 其原子核内中子数和质子数都是 m
B. 其原子核内中子数为 ( n - m ) 个, 核外电子数为 m 个
C. 其原子质量与 ![]() C 原子质量之比约为 n : 12
C 原子质量之比约为 n : 12
D. 其原子质量是![]() C 原子质量的 n 倍
C 原子质量的 n 倍
二、填空题(每空2分共18分)
7.根据周期律对角线规律,金属Be与铝单质及其化合物的性质相似,又已知AlCl3熔沸点较低且易升华,试回答下列问题:
(1)写出Be与NaOH溶液反应的离子方程式___________________________________
(2)Be(OH)2与Mg(OH)2可用试剂___________鉴别,其离子方程式是_________________
(3) BeCl2是_________(填离子化合物或共价化合物)
8. 为了保护环境,变害为利,工业上常用纯碱吸收有害气体SO2,同时得到NaHSO3,该反应的离子方程式为________________________;Na2SO3常用于除去漂白织物后剩余的游离氯,该反应的离子方程式为________________。
9. 工业上制取CuSO4不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡.
(1)写出反应的化学方程式___________________________________
(2)这种办法的优点主要有两处:一是___________________________________,
二是_______________________________
三、计算题(8分)
10. 向铜片中加入115mL某浓硫酸,在加热的条件下反应,待铜片完全溶解后, 将其溶液稀释到500mL,再加入足量的锌粉,使之充分反应,收集到2.24L(标准状况下)的气体。过滤残留固体,干燥后称重,质量比加入锌的质量减轻了7.5g。求原硫酸的物质的量浓度。
高一级化学科第二学期期中考试
试卷参考答案
甲卷(100分)
一、二、选择题:(每小题4分,共64分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | B | C | D | B | C | C | B | A | BC | AC | BD | D | A | BC |
三、填空题(每空2分共20分)
|
17. (1) 2CO+2NO ====== 2CO2+N2
(2) SO2转化为SO3,产生硫酸酸雾
(3)A、B
18. 核电荷数(质子数),最外层电子数,HClO4,HF
19. C是Mg D是Cl
B元素在周期表中的位置中的第三周期、ⅣA
四、实验题(8分)
20. (1)(2分)证明气体中不含SO2。(2)(3分)f,e接c,d接b。(3)(3分)A中溶液变白色浑浊;B中品红溶液不褪色;C中溶液紫色逐渐变浅。
五、计算题
21. (4分)0.74t
乙卷(50分)
一、选择题(24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 | D | CD | C | D | D | BC |
二、填空题(每空2分共18分)
7. (1)Be+2OH- ==== BeO22-+H2↑
(2) NaOH,Be(OH)2+2OH- ==== BeO22-+2H2O
(3)共价化合物
8. 2SO2+CO32-+H2O ==== 2 HSO3-+CO2↑ SO32-+H2O +Cl2 ==== SO42-+2Cl-+2H+
9. (1)2Cu +2H2SO4+O2 ===== 2CuSO4 + 2H2O
(2)一是不产生污染空气的二氧化硫,二是提高了硫酸的利用率
五、计算题(8分)
10. 解:n(H2)=![]() =0.1mol
=0.1mol
所以与硫酸反应生成H2的锌的物质的量为n(Zn)=0.1mol,质量为 m(Zn)=6.5g
生成的n(ZnSO4)=0.1mol (2分)
CuSO4 + Zn ======== ZnSO4 + Cu △m
1mol 65g 1mol 64g 1g
a b 7.5g-6.5g=1g
所以:a = b = 1mol (2分)
|
Cu +2H2SO4 (浓) ===== CuSO4 +SO2↑+ 2H2O
已知n(CuSO4)=1mol 故有n(SO2) =1mol
根据S元素守恒:n(H2SO4)=n(ZnSO4) + n(SO2)
=1mol+0.1mol +1mol
=2.1 mol (2分)
c(H2SO4) =![]() =18.3mol/L
(2分)
=18.3mol/L
(2分)
答:原硫酸的物质的量浓度为18.3mol/L。