高一级化学科第一学期期中考试
试卷
考试时间:120分钟 满分:150分
甲卷(100分)
可能用到的相对原子质量:Na:23 H: 1 O:16 N:14 C:12 k:39 Rb:85
一、选择题:(每小题只有一个正确答案,每小题3分,共30分)
1.下列反应中,SO2被还原的是
A.SO2+2NaOH == Na2SO3 B. SO2+Cl2+2H2O == H2SO4+2HCl
C.SO2+2H2S== 3S↓+2H2O D.SO2+NO2 == SO3+NO
2.下列实验操作中,正确的是
A.用托盘天平称量药品时,左盘放药品,右盘放砝码。
B.向试管中滴加试剂时,将滴管下端紧靠试管内壁。
C.烧瓶和烧杯在酒精灯上直接加热。
D.使用试纸检验溶液的性质时,将试纸浸入溶液中。
3. 某元素在化学反应中由化合态变为游离态,则该元素
A.一定被氧化了 B. 一定被还原了
C.既可能被还原也可能被氧化 D.既不可能被氧化又不可能被还原
4.下列离子方程式正确的是
A.大理石和硝酸:CO32- + 2H+ == H2O + CO2↑
B.铁和稀盐酸: 2Fe + 6H+ == 2Fe3+ + 3H2↑
C.稀硫酸和氨水 H+ + OH- == H2O
D.碳酸氢钙溶液和盐酸:HCO3- + H+ == H2O + CO2↑
5. 在NaOH溶液中能大量共存的离子组是
A.K+、HCO3-、Cl-、SO42- B.S2-、CO32-、Cl-、K+
C.K+、Cu2+、SO42-、Na+ D.Na+、Mg2+、NO3-、SO42-
6.吸热反应一定是
A.反应物总能量低于生成物总能量 B.释放能量的反应
C.反应物总能量高于生成物总能量 D.需要加热才能进行的反应
7.金属钠和金属钾比较。下列说法错误的是
A.金属性:钾比钠强 B.原子半径:钾比钠大
C.还原性:钾比钠强 D.熔点:钾比钠高
8. 进行焰色反应检验K+ 时有以下步骤:①蘸取待测夜;②置于酒精灯焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝,其中正确的操作顺序是
A.④②①②③ B.①②③④
C.④①②③ D.②①②③④
9. 下列化学反应离子方程式,不能只用Ba2+ + SO42- ==== BaSO4↓表示的是
A.氯化钡溶液跟稀盐酸混合 B.硝酸钡溶液跟稀硫酸混合
C.氯化钡溶液跟硫酸溶液混合 D.氢氧化钡溶液跟硫酸铜溶液混合
10.下列四种物质的溶液,其中一种与其它三种能发生离子反应,这种物质是
A. H2SO4 B. KOH C. BaCl2 D. Na2CO3
二、选择题(每小题有一个或两个选项符合题意。每小题4分,共32分。正确答案只有一个选项的,多选或错选给0分;正确答案有两个选项的,只要选错一个就给0分,只选了一个且为正确的给2分)
11. 下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液 B.金属钠在氯气中燃烧
C.铁片置于硫酸铜溶液中 D.金属钠放入水中生成氢氧化钠和氢气
12. 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
A.3.38g B.4.16g C.4.58g D.4.41g
13. 已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
A.2W-+Z2=2Z-+W2 B.2X-+Z2=2Z-+X2 C.2Y-+W2=2W-+Y2 D.2Z-+X2=2X-+Z2
14.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
15.现有三个氧化还原反应:
2FeCl3 + 2KI == 2FeCl2 + 2KCl + I2 2FeCl2 + Cl2 == 2FeCl3
2KMnO4+16HCl(浓)== 2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,欲氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
16.在5NH4NO3 ==== 2HNO3 + 4N2↑ + 9H2O中发生氧化反应的氮原子和发生还原反应的氮原子的质量比是
A.1 :1 B.3 :5 C. 5 :3 D. 2 :8
17.将Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是( )
A.溶液中只有气体产生
B.溶液中只有沉淀产生
C.溶液中可能有反应:Ca2++OH-+HCO-3=CaCO3↓+H2O发生
D.溶液中可能有反应:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O发生
18.下列物质放置在空气中因发生氧化还原反应而变质的是( )
A.NaOH B.Na2O C.Na D.CaO
三、填空题(每空2分共20分)
19. 完成下列离子方程式
(1)CO2+( )= HCO3-
(2)( )+Ca2++2OH-= CaCO3↓+( )
(3)(NH4)2SO4溶液与Ba(OH)2溶液混合加热
(4)Cu和AgNO3的溶液
20. S2-,Fe2+,Fe3+,Mg2+,S,I-,H+中,只有氧化性的是__________,只有还原性的是___________,既有氧化性又有还原性的是__________
21.通常用饱和NaHCO3溶液除去混在CO2中的少量的HCl气体,其离子方程式为______________________,而不用NaOH溶液的原因(用离子方程式表示)为__________,也不用饱和Na2CO3溶液的原因(用离子方程式表示)为__________.
四、实验题(8分)
22.草木灰中含有KCl、K2CO3等钾盐,从草木灰中提取钾盐的实验步骤是:
称量→溶解→过滤(再过滤)→滤液蒸发→冷却结晶
下列问题:
(1)用托天平(指针向的)称量样品时,若指针偏右边,则表示( )
A.左盘重,样品轻 B.左盘轻,砝码重C.右盘重,砝码轻D.右盘轻,样品重
(2)在进行第三步操作时,有时可能要重复进行,这是由于_________________________
(3)在进行第四步操作时,要用玻璃棒不断小心地搅动液体,目的是防止______________
⑷蒸发,当蒸发皿中出现多量固体时,即应该停止加热,其原因是______________
五、计算题
23. (4分)实验室用Cu与HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
(1)写出Cu与浓HNO3反应的化学方程式
(2)若实验室想制取23g NO2气体,反应中有多少g HNO3被还原?
24.(6分)将agNa溶于bg水中,a1gNa2O溶于b1g水中,a2gNa2O2溶于b2g水中,均得到溶质质量分数为8%的溶液.计算回答:
(1)当a1:a2=31:39时,则b1:b2=__________.
(2)若a=4.6g,则b=__________g.
乙卷(50分)
一、选择题(每小题有一个或两个选项符合题意。每小题4分,共24分。正确答案只有一个选项的,多选或错选给0分;正确答案有两个选项的,只要选错一个就给0分,只选了一个且为正确的给2分)
1.3个SO32-恰好将2个XO4-离子还原,则x元素在还原产物中的化合价是
A.+1 B.+2 C.+3 D.4
2. 含有锂和另一种碱金属组成的混合物,取4g与水充分反应后,得到0.1gH2,则另一种碱金属不可能是( )
A.Na B.K C.Rb D.Cs
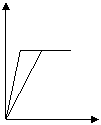 3. 少量的钠、钾投入一定量的稀盐酸中,产生气体随时间的变化的曲线如图所示,则下列说法中正确的是
氢气质量(g)
A.投入的钠、钾一定等质量
b
3. 少量的钠、钾投入一定量的稀盐酸中,产生气体随时间的变化的曲线如图所示,则下列说法中正确的是
氢气质量(g)
A.投入的钠、钾一定等质量
b
B.投入的钠的质量小于钾的质量 a
C.曲线a代表钠,曲线b代表钾 时间(s)
D.稀盐酸的量一定是不足量的
4.下列各组离子不能在水溶液中大量共存的是
A.K+、Br-、HCO3-、CO32- B.Na+、OH-、S2-、CO32-
C.Na+、Rb+、HCO3-、CO32- D.Li+、OH-、HCO3-、CO32-
5. 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2与盐酸,Cu(OH)2与醋酸
B.BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液
C. 石灰石与硝酸反应,石灰石与盐酸
D. NaHCO3溶液与NaHSO4溶液,Na2CO3溶液与NaHSO4溶液
6. 向紫色石蕊试液中加入过量Na2O2粉末,振荡,下列叙述中正确的是
A.溶液仍为紫色 B.最后溶液变蓝色
C.最后溶液褪色 D.有气泡产生
二、填空题(每空2分共18分)
7.有一包白色固体粉末,它是碳酸钠、硫酸钾、亚硫酸钾、氯化钠和氯化钡中2种或多种混和而成。为判断其成分进行以下实验:
(1)加水溶解搅拌后,仍有少量不溶物;
(2)进行焰色反应时,可见火焰呈黄色,隔蓝色钴玻璃观察时,发现火焰呈紫色;
(3)滤出少量不溶物,加足量盐酸时,有无色无刺激性气体产生,不溶物中仍留下一部分不溶于盐酸.上述白色粉末中一定含有____________________一定没有_____________可能含有___________
8. 把ag固体NaHCO3加热一段时间后,固体质量为bg,则生成的Na2CO3__________g,尚有__________gNaHCO3未分解;当b值为__________时,NaHCO3完全分解(以上均用含a、b的代数式表示).
9. 宋代初期,人们发现江西上饶有一苦泉,蒸发这种苦泉水会得到蓝色晶体,熬苦泉水的铁锅用久了会变成铜锅,这也是湿法炼铜的起源。写出这个反应的离子方程式并 标出电子转移的方向和数目(单线桥法),____________________________________。
该反应中的还原产物是_____________.还原剂是_____________.
三、计算题(8分)
10.在120℃时,将24.8gCO2和H2O(g)的混合气体缓缓通过过量的过氧化钠固体,充分反应之后,固体质量增加了12g,请计算:
⑴产生氧气的质量
⑵原混合气体中CO2的质量
第一学期期中考试
高一级化学科试卷参考答案
甲卷(100分)
一、二、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | A | C | D | B | A | D | A | D | A | CD | B | BC | B | C | C | CD | C |
三、填空题(每空2分共20分)
19. (1)CO2+( OH- )= HCO3-
(2)( CO2 )+Ca2++2OH-= CaCO3↓+( 2H2O )
|
(4)Cu + 2Ag+ ==== Cu2+ + 2Ag
20. Fe3+、Mg2+、H+, I-、 S2-, Fe2+、S。
21. HCO3-+ H+ = CO2↑+H2O CO2 + 2OH- = CO32-+H2O
CO2 + H2O + CO32-= 2HCO3-
四、实验题(8分)
22. (1) B (2)滤液可能仍然浑浊。(3)防止局部过热而使液体飞溅出来。(4)当出现较多量固体时,靠蒸发皿内的余热就能完成剩余的蒸发。
五、计算题
23. (4分)(1)Cu+4HNO3(浓)===== Cu(NO3)2+2NO2↑+2H2O (2)31.5g
24.(6分)(1)1:1 (2)95.6g
乙卷(50分)
一、选择题(24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 | D | AB | BC | D | C | CD |
二、填空题(每空2分共18分)
7. 碳酸钠、硫酸钾、氯化钡, 亚硫酸; 氯化钠
![]() 8.
8. ![]() 、
、![]() 、
、 ![]() 。
。
9. Cu2+ + Fe ==== Cu + Fe2+ Cu Fe
五、计算题(8分)
10. ⑴产生氧气的质量为12.8g
⑵原混合气体中CO2的质量17.6g