高一下期第一次双月考化学试题(氧族、周期律)
(时间:100分钟 总分:100分)
可能用到的相对原子质量:
H=1 C=12 N=14 O=16 F=19 S=32 Na=23 Mg=24 Ba=137
化学第一卷(选择题 共50分)
一、单选题(本题共20道小题,每小题只有一个正确选项,每小题2分,共40分。)
1. 某元素的原子最外层有两个电子, 该元素
A. 是ⅡA族元素 B. 是金属元素
C. 是稀有气体元素 D. 无法确定属哪一类
2. 以下物质不能用于脱色或漂白的是
A.SO2 B.Na2O2 C.活性碳 D.H2S
3. 导致下列环境问题的主要原因与排放二氧化硫有关的是
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
4. 浓硫酸与金属铝在加热条件下反应,得不到氢气,这是因为浓硫酸具有:
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
5. X是一种黑色粉末,它和浓硫酸共热发生反应,生成无色气体,能使澄清石灰水变得浑浊,当X在氧气中燃烧时也生成无色气体,则X是:
A.硫粉 B.MnO2 C.木炭粉 D.铁粉
6.下列各组指定原子序数的元素, 能够形成A2B3型化合物的是
A. 12和17 B. 11和9 C. 13和8 D. 16和8
7.共价键可存在于
A.单质 B.离子化合物 C.共价化合物 D.以上各类物质中
8.原子(![]() E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则Z的数值是
E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则Z的数值是
A.12 B.15 C.16 D.17
9. 下列各组离子中, 全组离子均与氖原子电子层结构相同是
A.Na+、Mg2+、Al3+、K+、Ca2+ B.Li+、Na+、F-、O2 -、Cl-
C.Na+、Mg2+、Al3+、O2-、F- D.S2-、Cl-、K+、Ca2+、Na+
10.下列物质的电子式, 正确的是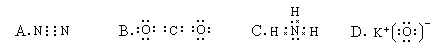
11.元素X的原子获得3个电子和元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的化学式为
A.Y3X2 B.X2Y2 C.X3Y2 D.Y2X3
12. 下列物质中,含有极性共价键的离子化合物是
A.MgCl2 B.NaOH C.H2S D.SiH4
13. 比较S2-和S的性质,下列叙述正确的是:
A.S2-只具有还原性而S只具有氧化性
B.S2-和S都是不溶于水的淡黄色固体
C.S2-半径比S大,但氧化性S大于S2-
D.它们在空气中都一定能燃烧且都能生成具有刺激性气味的气体
![]() 14.
14.
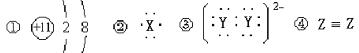
A. ③②①④ B. ③④①② C. ②④③① D. ②④①③
15. 同温同压下,体积相同的两个容器中,分别充满由14N、13C、18O三种原子构成的一氧化氮(14N18O)和一氧化碳(13C18O).下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的质子和中子
C.含有相同的分子数和电子数 D.含有相同数目的中子、原子和分子
16.水和重水(![]() H
H![]() O)分别跟金属钾反应, 若电子转移的数目相同时, 下列化学量相等的是 ①消耗水和重水质量
②同温同压下生成气体的体积
O)分别跟金属钾反应, 若电子转移的数目相同时, 下列化学量相等的是 ①消耗水和重水质量
②同温同压下生成气体的体积
③生成气体的质量 ④参加反应的钾的物质的量
A. ①③ B. ②④ C. ①④ D. ②③
17. X和Y均为短周期元素,两者组成的化合物为X3Y2, 若Y的原子序数为m,则X的原子序数不可能是:
A. m+6 B. m+5 C. m-3 D. m-11
18.二氧化硫和氯气都有漂白作用,现把二者以等物质的量混合,让混合物通过湿的有色布条时,其漂白效果
A.和氯气单独通过时相同 B.和二氧化硫单独通过时相同
C.是二者作用效果之和 D.可能失去漂白作用
19. 下列哪组物质都可以充当杀菌消毒剂
A.Cl2、S、P B.CO2、SO2、HClO C.Cl2、SO2、H2O2 D.Cl2、SO2、K2CO3
20. A和B是短周期的两种元素, 它们的离子A-和B2+具有相同的核外电子层结构,下列说法正确的是
A.原子序数A>B B.电子数A>B C. 原子半径A>B D. 离子半径A->B2+
二、多选题(本题共5道小题,每小题有1-2个正确答案,每小题2分,共10分。)
21. 各组元素原子半径逐渐变小,氧化性逐渐增强的是
A.K、Na、Li B.P、S、O C.Si、P、O D.O、S、Cl
22. 钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质是:
A.钋是能导电的固体 B.钋与氢气不能直接化合
C.钋的氢化物很稳定 D.钋的熔点较高
23. 关于浓硫酸的叙述错误的是
A.常温下可使金属Fe钝化,故可用铁制器皿盛装浓硫酸
B.在加热条件下可将木炭氧化,其还原产物为CO2和SO2
C.是难挥发的粘稠液体 D.不具有酸性
24. 已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
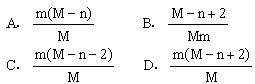
25. 据报道,1994年兰州近代物理研究所研制出首批氧-18气体.氧-18(18O![]() )又称重氧,下列有关叙述正确的是(NA表示阿伏加德罗常数)
)又称重氧,下列有关叙述正确的是(NA表示阿伏加德罗常数)
A. 11.2 L重氧所含分子数为0.5NA B. 36g重氧气体所含原子数为2NA
C. 2g重氧水(H218O)所含中子数为NA D. 1.8g重氧气体的物质的量为0.1mol
化学第二卷(非选择题、共50分)
三、填空题(本题共4道小题,共20分。)
26.(4分) 在O、S、Se、Te四种元素中,单质氧化性最强的化学式是___,简单阴离子还原性最强的离子符号为____. 硒元素最高价氧化物的水化物的化学式为______,它与足量的氢氧化钠溶液反应的化学方程式为_______.
27.(6分) 用化学符号表示符合下列条件的微粒:
(1)含有10个电子的分子有: Ne、 HF 、____、 和 CH4 。
(2)含有10个电子的阳离子有: Na+、____、____、 NH4+和 H3O+。
(3)含有10个电子的常见阴离子有:___、____、和 OH-。
28.(8分)A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族, 两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子, 则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 , 它的电子式是 ,它属于 化合物。
29.(2分)R2-的M电子层与L电子层的电子数目相等, 元素R应处于周期表的___周期____族.
四、简答题(本题共2道小题,共12分。)
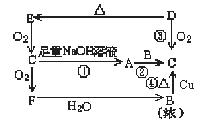 30.(8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素.
30.(8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素.
(1) 写出各物质的化学式:
A: B: C: D: E: F:
(2) 写出①④的化学方程式:
①
④
31.(4分) 按指定元素的价态变化,各写一个化学方程式(每个化学方程式只能用一次)

五、实验题(本题共1道小题,共7分。)
32.(7分)酸性高锰酸钾溶液是一种常用强氧化剂,在化学实验中可用于吸收二氧化硫气体。浓H2SO4与炭反应,生成的气体产物用下图装置来确认。
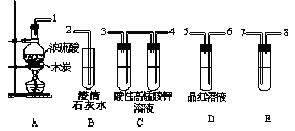
请用仪器间相互联接处的标号,写出联接顺序:
__1___接___7_;_____接____;_____接____;___5__接__2____.
并回答:
(1)E试管中盛放的试剂是 ,作用是 .
(2)D装置的作用是 .
(3)写出A装置中反应的化学方程式 ,
B装置中反应的离子方程式 .
六、计算题(本题共2道小题,共11分。)
33.(7分)某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100t。试计算:
⑴如果煤中的硫全部转化为二氧化硫,每天可以产生二氧化硫的质量是多少吨?
⑵这些二氧化硫在标准状况是多少立方米?
 34.(4分)
34.(4分)
说明:这一部份习题一般同学可以不做。
1.(10分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸正盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
参考答案
一.单选题(本题共20道小题,每小题只有一个正确选项,每小题2分,共40分。
1. D 2.D 3.A 4.B 5.C 6.C 7.D 8.B 9.C 10.C
11.A 12.B 13.C 14.A 15.D 16.B 17.A 18.D 19.C 20.D
二.多选题(本题共5道小题,每小题有1-2个正确答案,每小题2分,共10分。)
21.BC 22.C 23.BD 24.D 25.BC
三、填空题(本题共4道小题,共20分。)
26.(4分) O2, Te2-. H2SeO4, H2SeO4+2NaOH=2H2O+Na2SeO4.
27.(6分)(1) H2O、NH3。(2) Mg2+、Al3+、
(3) O2-、F-、28.(8分)![]() ;
; ![]() ; H2S,
; H2S, ![]() 共价; Na2S ,
共价; Na2S , ![]() 离子 。29.(2分)3 ⅥA .
离子 。29.(2分)3 ⅥA .
四、简答题(本题共2道小题,共12分。)
30.(8分)A: Na2SO3 B: H2SO4 C: SO2 D: H2S E: S F: SO3
① SO2+2NaOH= Na2SO3+H2O ④ Cu+2 H2SO4(浓)![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
31.(4分)

五、实验题(本题共1道小题,共7分。)
32.(7分)___8__接__4___;__3___接__6___;
(1) __品红溶液____, _____检验二氧化硫气体_____.
(2) _证明二氧化硫气体已除尽.
(3) _C+2H2SO4(浓)![]() CO2↑+SO2↑+2H2O_,CO2+Ba2++2OH-=_ BaCO3↓ +H2O
CO2↑+SO2↑+2H2O_,CO2+Ba2++2OH-=_ BaCO3↓ +H2O
六、计算题(本题共2道小题,共11分。)
33.(7分) (1)0.32t (2)112m3
34.(4分) 第1空:9.32 第2空:0.2
选作题(共20分)
说明:这一部份习题一般同学可以不做。
1.(10分)(1)③②⑤(不要求顺序,多1,少1,错1,均为0分) (2分)
(2)②⑤⑥④① (2分)
(答②⑤⑥④算对,其它写法为0分)
(3)2,使瓶内外压强相等 (2分)
(写出其它合理的与大气相通的方法,如多孔也算对.1空1分,共2分)
(4)冒气泡 (1分)
(5)用量筒量取33(或34)毫升30%H2O2溶液加入烧杯中,再加入67(或66)毫升水(或加水稀释至100毫升),搅拌均匀 (2分)
(6)ClO-+H2O2=Cl-+O2↑+H2O (1分)
2.(10分)
(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2) mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案 =。
(3)2种 、 Li2CO3 MgCO3 。