高一化学第一次月考试卷
时量:90分钟 总分100分
一、单项选择(共50分)
1 某超重元素的原子符号为277112R ,在这种原子中中子数与电子数之差为:
A 46 B 53 C 165 D 112
2 位于周期表的ⅡA族和 ⅢA族的元素,原子序数的差不可能是
A 1 B 11 C 10 D 25
3 在化学反应中,下列数据会发生变化的是
A 电子数 B 质子数 C 中子数 D 质量数
4 下列各组物质中,互为同位素的是:
A 金刚石与石墨 B水与重水 C纯碱与烧碱 D 氕与氘
5 下列物质中既含离子键又含非极性键的是:
A KOH B Na2O C Na2O2 D H2O
6 下列物质的熔点最高的是:
A NaF B NaI C 冰 D 干冰
7 含有相同 质子数的微粒一定是:
A 同一种元素B 同一种原子 C 同一种分子 D 不能确定
8 在核电荷数为1--20的元素的原子中, 次外层电子数为最外层电子数2倍的元素有:
A 1种 B 2种 C 3种 D 4种
9 下列化合物中阳离子与阴离子半径比值最小的是:
A NaF B MgI2 C BaI2 D KBr
10 下列各组原子序数的两种元素能形成AB2型离子化合物的是:
A 6和8 B 11和13 C 11和6 D 12和17
11 X、Y、Z三种元素在周期表中,X、Y同主族,Y、Z同周期,它们的原子的最外层电子数之和为16,则这三种元素可能是:
A Na、K、Ca B N、P、S C F、Br、Al D O、S、Cl
12 下列哪种元素的原子在形成化合物时形成化学键种类最多:
A Na B Ne C Cl D C
13 根据元素周期表推测第八周期最多可填满多少种元素
A 32 B 50 C 68 D 72
14下列说法中错误的是:
A 原子及其阴离子的核外电子层数等于该元素所在的周期数
B 周期表中从ⅢB族10个纵行的元素都是金属元素
C除氦外的稀有气体原子的最外层电子数都是8
D 同种元素的各种同位素形成的单质的物理性质、化学性质都相同
15 短周期元素X、Y可形成化合物X2Y3,若已知Y的原子序数为m,则X的原子序数不可能的是:
A m +6 B m +3 C m -3 D m -11
16NA为阿佛加德罗常数,2克重氢分子中电子数为:
A NA B 1/2NA C 1/4NA D 2NA
17 元素X的一种核素abX,元素Y的一种核素为cdY,已知a>c,b>d,则元素X和Y的相对原子质量的关系为
A X>Y B X<Y C X=Y D 不能确定
18 下列性质中,可以证明其化合物内一定存在离子键的是:
A 可溶于水 B 具有较高的熔点 C 水溶液能导电 D 熔融状态能导
19 硼有两种天然同位素105B、115B,硼元素的近似相对原子质量为10.8,下列对硼元素中105B的质量分数的判断中正确的是:
A 20% B >20% C <20% D 80%
20 下列分子中所有原子都满足最外层有8个电子结构的是:
A COCl2 B SF6 C XeO2 D BF3
21 1999年曾报道合成和分离出含高能量的正离子N5+ 的化合物N5AsF6 ,下列叙述错误的是:
A N5+正离子共有34个核外电子 B N5+中氮原子间以共用电子对结合
C 化合物N5AsF6中As化合价为+1 D 化合物N5AsF6中F化合价为-1
22 下列说法正确的是:
A 含有共价键的化合物一定是共价化合物 B 分子中只有极性键的物质一定是共价化合物
C 非极性键不能存在于化合物中 D 只有非金属原子间才能形成共价键
23 X-、Y+、Z2-、W-四种离子的电子层数为n或n-1,离子半径为Z2->W->X->Y+ ,则四种元素的质子数为:
A W>Z>Y>X B Z>W>Y>X C X>Y>Z>W D X>Y>W>Z
24 M、N两种元素的原子,当它们获得两个电子形成稀有气体元素的电子层结构的离子时,M放出的能量大于N,那么可知:
A M单质的氧化性比N强 B M单质的还原性比N强
C N2- 还原性比M2- 弱 D M 原子半径比N原子半径大
25 R1、R2为元素R的两种同位素,相对原子质量分别为M1、M2,原子个数百分比分别为X1、X2,若R为一价主族元素,则R的硝酸盐的相对分子质量为:
A M1X1+M2X2 B (M1+M2)/2 +62
C (M1 +M2)(X1 +X2)+62 D M1X1 +M2X2 +62
第二卷
26 3.7克某核素的一种微粒3717R-中,中子数约有① mol,电子数约有② mol。
27 某原子的原子序数为53 ,该元素位于周期表中第①周期的第②族。
| D | ||
| A | B | C |
| E |
28 在周期表有五种元素,它们在周期表的位置如右图所示,
已知它们的最外层电子数之和为30,且原子序数最大的不超过36。试回答:
⑴A在元素周期表里的位置是① 周期② 族。
⑵E的元素符号是③ 。
⑶B的(金属性或非金属性) ④ 较⑤ 为弱,较⑥ 为强。
⑷B的最高价氧化物的水化物分子式是⑦ ,其酸性较⑧ 为强,较⑨ 为弱。
⑸B单质与C单质比较其(氧化性、还原性) 较为(强、弱) 。实验依据是(用化学方程式表示) 。
29 有X、Y、Z三种元素的原子序数依次增大,且位于同一周期,价电子数之和为10,它们的最高价氧化物的水化物之间任意两种都能反应生成盐和水,M元素与上述三种元素位于相邻的周期,面M原子的L电子 有4个电子 ,回答下列问题:
⑴X、Y、Z、M的元素符号分别为X ①、Y ②、Z ③、M ④ 。
⑵Y位于元素周期表的第⑤ 周期第⑥ 族。
⑶Z原子的结构示意图为:⑦ 。
⑷X单质跟水反应的离子方程式是⑧ 。
30 写出下列化合物的电子式:CO2① HClO② NaF③
31 原子序数大于4的主族元素,X、Y的离子Xm+、Yn-它们的核外电子排布相同,据此推断:X和
Y所属周期数之差为① ,X和Y的核电荷数之差为② ,Y和X的族序数之差为③ 。
32 A+、B+、C-、D、E五种微粒,都含有10个电子,已知①A+ +C-=D +E↑
②B+ +C-=2D,请回答:⑴C-离子的电子式是① ,⑵分别写出A+和D反应、B+和E反应的离子反应方程式② 、③。
33 化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10ml该气体能分解生成15mlO2和10mlF2(条件相同)。⑴A的化学式是① 推断的依据是② ⑵已知A分子中x个氧原子呈…O─O─O…链状排列,则A分子的电子式是③ 结构式是④
34 A、B、C、D 4种短周期元素的原子序数依次增大,A、D同族,B、C同周期,A、B组成的化合物甲为气态,其中A、B的原子数之比为4:1,由A、C组成的两种化合物乙和丙都是液体,乙中A、C原子数比为1:1,丙中A、C原子数比为2:1,由D、C组成的两种丁化合物和戊都为固态,丁中D、C原子数比为1:1,戊中则为2:1.
⑴写出甲、乙、丙、丁、戊的化学式分别是
甲 ① 、乙 ② 、丙 ③ 、丁 ④ 、戊⑤ 。
⑵乙的电子式是⑥
⑶写出B元素的最高价氧化物与丁发生反应的化学方程式⑦ 。
⑷在上述五种物质中是离子化合物的有:⑧
35电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后两极共生成气体18.5g,其体积为33.6L(标态),求生成的气体中,重氢和普通氢的原子个数比是多少?
高一月考答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 选项 | B | C | A | D | C | A | D | B | B | D | B | C | B | D | A |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |||||
| 选项 | A | D | D | C | A | C | B | A | A | D |
![]()
![]()
 一、单项选择:共50分
一、单项选择:共50分
从26题到34题每空1分,共45分。第35题5分。
26 ① 2 ② 1.8 27① 5 ② ⅦA
28⑴ ① 三 ② ⅤA ⑵③ Se ⑶ ④ 非金属 ⑤ Cl2 ⑥ Se
⑷⑦ H2SO4 ⑧H3PO4 ⑨ HClO ⑸ 氧化性 、 弱 , Cl2 +S2-=2Cl- +S↓
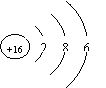 |
29① Na ② Al ③ S ④ C ⑤ 三 ⑥ ⅢA ⑦
⑧ 2Na +2H2O=2Na+ +2OH-+H2↑
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 30① O C O
② H
O Cl ③ Na+
30① O C O
② H
O Cl ③ Na+
31① 1 ② m+n ③ 8-m-n
![]()
![]()
![]() 32① O H -
② NH4++H2O = NH3·H2O
+H+ 、③ H3O++NH3
= H2O+NH4+
32① O H -
② NH4++H2O = NH3·H2O
+H+ 、③ H3O++NH3
= H2O+NH4+
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 33①
O3F2 ② 阿佛加德罗定律 ③ F O O O F ④F-O-O-O-F
33①
O3F2 ② 阿佛加德罗定律 ③ F O O O F ④F-O-O-O-F
34① CH4 ② H2O2 ③ H2O ④ Na2O2 ⑤ Na2O
![]()
![]()
![]()
![]()
![]() ⑥
H O O H ⑦
2CO2+2Na2O2=2Na2CO3+O2↑ ⑧ Na2O2 ,Na2O
⑥
H O O H ⑦
2CO2+2Na2O2=2Na2CO3+O2↑ ⑧ Na2O2 ,Na2O
![]() 35
1 3
35
1 3