高一化学第一学期末考试
试卷
(本卷满分100分,考试时间100分钟)
可能用到的相对原子质量:H 1、C 12、O 16、S 32、Cl 35.5 Na 23、Mg 24、Al 27、K 39、Cu64、Zn 65、Ag108、Ba137
一、选择题:(每小题只有1个选项符合题意,每题2分,共10分)
1、下列变化属于化学变化的是
A、将金属钠与金属钾混合研磨,变为液体
B、氯化钠置于火焰上燃烧,火焰呈黄色
C、金属钠置于空气中,表面变得暗淡无光
D、从草木灰中提取钾盐
2、已知钡的活动性是处于Na、K之间,则下列说法中可能实现的是
A、Ba可以KCl溶液中置换出钾
B、Ba可从冷水中置换出H2
C、在溶液中Ba2+可氧化Zn成为Zn2+
D、Ba投入到NaOH溶液中,没有明显的现象发生
3、下列物质中,不能跟二氧化碳气体反应的是
A、 过氧化钠 B、氢氧化钾 C、碳酸钠溶液 D、碳酸氢钠
4、下列物质中所含指定的微粒数最多的是
A、标准状况下,4.48L二氧化碳所含的原子数 10 D
B、4mol/L H2SO4 100mL中所含氢离子数
C、106g碳酸钠中所含氧原子个数
D、4℃时224mL水所含的水分子数
5、在一密闭容器中,盛aL Cl2和H2的混合气体,用电火花引燃,恢复原来的状态,发现混合气体仍为aL,用足量的NaOH吸收引燃后的气体,结果气体被完全吸收,由上可知原混合气体中Cl2和H2的体积比一定为
A、1:1 B、≥1:1 C、≤1:1 D、任意比
9、C 6、用足量MnO2与含4molHCl的浓盐酸共热,在不考虑HCl挥发的情况下得到的Cl2为
A、2mol B、1mol C、大于2mol D、小于1mol
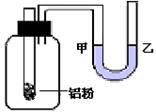 7、右图为某学生设计的一个实验装置。现往大试管中(装有铝粉)加入一定量的盐酸。在滴入盐酸到反应停止前,可以看到甲、乙处液面
7、右图为某学生设计的一个实验装置。现往大试管中(装有铝粉)加入一定量的盐酸。在滴入盐酸到反应停止前,可以看到甲、乙处液面
A、甲处上升、乙处下降
B、甲处下降、乙处上升
C、甲处和乙处液面均不变
D、甲处和乙处液面均一会儿升、一会儿降。
8、分析下列反应:CaH2+2H2O=Ca(OH)2+2H2↑下列说法正确的是:
A、该反应属复分解反应
B、H2O既是氧化剂又是还原剂
C、氧化剂与还原剂物质的量之比为2:1
D、若反应中生成1mol氢气,则有2mol电子发生转移
9、只表示一个化学反应的离子方程式为
A、CO32-+2H+=H2O+CO2↑
B、2Br-+Cl2=2Cl-+Br2
C、SO2+Cl2+2H2O=4H++2Cl-+SO42-
D、Ba2++SO42-=BaSO4↓
10、下列物质①Na②F2③Na2O2④Na2O⑤Cl2⑥CO2能与水发生氧化还原反应,且水在此反应中既不是氧化剂又不是还原剂的是
A、②和③ B、③和④ C、③和⑤ D、③④⑤⑥
二、选择题(每小题有1—2个选项符合题意,少选扣2分,多选、错选均不给分,每题3分,共30分)
11、某元素由化合态变为游离态
A、此反应一定是氧化还原反应
B、该元素一定被氧化
C、该元素一定被还原
D、该元素可能被氧化,也可能被还原
12、下列贮存化学试剂的方法正确的是
A、新制的氯水保存在棕色试剂瓶中,并放在阴凉处
B、用做感光片的溴化银贮存在无色试剂瓶中
C、烧碱溶液放在带玻璃塞的磨口试剂瓶中
D、金属钠保存在煤油中
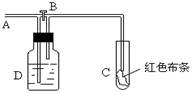 13、如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是:
13、如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是:
A、D中可以是浓硫酸
B、通入的氯气含有水份
C、D中可以是水
D、D中可以是饱和食盐水
14、15.6gNa2O2吸收一定量CO2气体后,其固体质量增加到18.4g,则吸收的CO2质量是
A、8.8g B、4.4g C、2.8g D、7.2克
15、在碱性溶液中能大量共存且为无色透明的溶液是
A.K、Cl-、MnO4-、SO42- B.Na+、SO42-、NO3-、CO32-
C.Na+、NO3-、SO42-、HCO3- D.Na+、Mg2+、SO42-、Cl-
16、下列离子方程式书写正确的是

17、下列关于碱金属铯及其化合物的说法,不正确的是
A、氢氧化铯是一种强碱
B、铯与水或酸反应强烈,都生成H2
C、Cs2CO3加热很易分解为CO2和Cs2O
D、Cs2SO4、Cs2CO3、Cs2SO3均易溶于水
18、在甲、乙两个试管分别装入质量相等的NaHCO3固体,甲试管加热到固体质量不再变化后冷却,再加入足量的稀盐酸;乙试管不经加热直接加入足量的稀盐酸。反应完全后,甲、乙两试管实际参加反应的盐酸的物质的量之比为
A、2∶3 B、1∶1 C、1∶2 D、2∶1
19、某温度时,将Cl2通入NaOH溶液中,反应后生成NaCl、NaClO、NaClO3的混合溶液,经测定ClO-和ClO3-浓度之比为1:1,则Cl2与NaOH反应时,被还原的氯原子与被氧化的氯原子物质的量之比为
A、1:1 B、2:1 C、3:1 D、4:1
20、一氧化氮是大气的污染的主要污染物之一,近几年来,又发现生物体内存在少量一氧化氮,它有扩张血管,增加记忆的功能,成为当今生物科学研究的热点。工业制取一氧化氮的化学方程式为:4X + 5O2 == 4 NO + 6H2O(条件略),则X的化学式是
A、N2H4 B、N2O C、NH3 D、N2O3
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题(每空2分,共38)
21、实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制200ml物质的量浓度为0.46mol/L的硫酸。
(1)现有下列几种规格的仪器,应选用 ;
①10mL量筒②50ml量筒③100mL量筒④100mL容量瓶⑤200mL容量瓶
(2)完成该实验还需要的仪器有 ;
(3)下列操作使所配溶液的物质的量浓度偏高的是 。
A、用量简量取的浓H2SO4,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液。
B、往容量瓶转移溶液时,有少量液体溅出。
C、未洗涤稀释浓H2SO4的小烧杯
D、定容时俯视刻度线
E、容量瓶未干燥即用来配制溶液
F、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
G、容量瓶中的硫酸倒入洗净并留有少量蒸馏水的试剂瓶中。
22、氧化二氯(Cl2O)是棕黄色的强刺激性气体,沸点3.8℃熔点-116℃。制备时生成的氧化二氯要及时冷却成固态以便操作和贮存。它与一般有机物接触会发生爆炸;遇水则极易溶解(1:100),生成次氯酸溶液。制备少量固态氧化二氯可用干燥HgO和Cl2反应,生成物为Cl2O和HgO![]() HgCl2,装置如下图:
HgCl2,装置如下图:
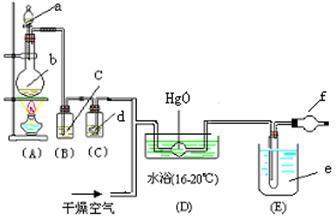
回答下列问题:
(1)写出Cl2与HgO反应的化学方程式
(2)写出所盛药品的化学式:a是 ,b是
(3)B中盛的液体c是 ,其作用是 。C中盛的液体d是 ,其作用是
(4)E为冷却装置,其中应盛致冷剂 [干冰(汽化温度-78℃)、冰水、液态氮气(汽化温度-196℃)]。
(5)f干燥管是为了防止空气中的水蒸汽进入e而与Cl2O发生反应生成次氯酸,该反应的化学方程式为 。
23、有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀消失,并有气泡产生。
⑶取少量⑵中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有 ,一定不含有 ,可能含有 。该实验中有关反应的离子方程式为 、 。
24、已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
(1)MnO2和HSCN的浓溶液共热的化学方程式:
(2)(CN)2和NaOH溶液反应的离子方程式:
四、计算题(每题6分,共12分)
25、取50mLNa2CO3和Na2SO4的混合溶液,加入过量的BaCl2溶液后得到4.3g白色沉淀,用过量的稀HNO3处理后沉淀减少到2.33g,并有气体放出。试计算:
(1)混合液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标况下的体积?
26、有一块表面被氧化成氧化钠的金属钠,质量为0.584g,放入足量的水中,当反应结束时,生成氢气 0.02g。
(1)此金属钠中有多少克钠在与水反应前已被氧化?
(2)若反应后的溶液为100mL,则所得氢氧化钠溶液的物质的量浓度是多少?
高一化学试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | D | B | D | B | C | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A、D | A、D | A、B | B | B | B | C | B | C | C |
第一、 二选择题(1~10题每空2分,11~20题每空3分,共50分)
三、填空题(每空2分,共36)
21、(1)①⑤
(2)烧杯、玻璃棒、胶头滴管(有错不得分,不全得1分)
(3)A、D
22、(1)2Cl2+2HgO= HgO![]() HgCl2+Cl2O
HgCl2+Cl2O
(2)浓盐酸,MnO2
(3)饱和食盐水(水),除HCl;浓硫酸,除水蒸气。
(4)液态氮气。
(5)Cl2O+H2O=2HclO
23、一定含有CaCO3、Na2SO4;一定不含有CuSO4、BaCl2;可能含有KNO3
CaCO3+2H+=Ca2+↑+CO2+H2O Ba2++SO42-=BaSO4↓
|
(1)MnO2+4HSCN====Mn(SCN)2+(SCN)2↑+2H2O
(2)(CN)2+2OH-=CN-+CNO-+H2O
四、计算题
25、(1)C(Na2CO3)=0.2mol/L C(Na2SO4)=0.2mol/L
(2)0.224L
26、(1)0.092g
(2)0.24mol/L