高一化学第一学期期末四校联考
高 一 化 学
命题人:云梦一中 周驹平 审题人:云梦一中 陈春年
注意事项:
1.本试题包括第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,请将答案填入答题栏内,第Ⅱ卷为非选择题,请将答案直接写在各题后。本试题满分为120分,考试时间90分钟。
2.可能用到的相对原子质量:H:1 O:16 F:19 Cl:35.5 Br:80 S:32
Fe:56 Na:23 Cu:64 Zn:65 Mg:24 Al:27
第Ⅰ卷(选择题,共60分)
一、选择题(本题共12小题,每小题3分,共36分,每小题只有一个选项符合题意)
1.下列微粒或物质中,化学性质最活泼的是 ( )
A.氯气分子 B.氯原子 C.氯离子 D.液氯
2.目前世界上最重要的气体矿物燃料是 ( )
A.煤气 B.水煤气 C.天然气 D.氢气
3.若用X代表F、Cl、Br、I四种卤族元素,下列一定条件下的反应属于它们的共性反应的是( )
A.X2+H2 == 2HX B.X2+H2O == HX+HXO
C.2Fe+3X2 == 2FeX3 D.X2+2NaOH == NaX+NaXO+H2O
4.将浓度为10%和20%的氢氧化钠溶液等质量混合,所得溶液的浓度 ( )
A.大于15% B.小于15% C.等于15% D.无法确定
5.元素从化合物中被置换成单质时,该元素 ( )
A.一定被氧化 B.一定被还原 C.可能被氧化,也可能被还原 D.既不被氧化,也不被还原
6.下列叙述正确的是 ( )
A.1molO2含有分子的准确数目是6.02×1023个 B.有单质参加的反应不一定是氧化还原反应
C.标准状况下,0.1molH2O的体积是22.4L D.通常状况下,5.6LH2含0.5molH原子
7.下列既能由金属与氯气化合生成,又能由金属与盐酸反应生成的氯化物是 ( )
A.CuCl2 B.ZnCl2 C.FeCl2 D.FeCl3
8.V升Fe2(SO4)3溶液中含有a克SO42-,取此溶液0.5V升,用水稀释至2V升,则稀释后所得溶液中Fe3+的物质的量的浓度为 ( )
A.mol·L-1 B.mol·L-1 C.mol·L-1 D.mol·L-1 9.检验氯化氢中是否混有Cl2 ,可采用的方法是 ( )
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
10.下列反应的离子方程式正确的是
( )
A.氟气通入水中:2F2+2H2O
== 4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水: Ca2++2OH-+2HCO3-
== CaCO3¯+CO32-+2H2O
C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42-==BaSO4¯
D.金属钠跟水反应: 2Na+2H2O == 2Na++2OH-+H2
11.在两个容积相同的容器中,一个盛有HCI气体,另一个盛有H2和CI2的混合气体。在同温同压下,两容器内的气体一定具有相同的 ( )
A.原子数 B.密度 C.质量 D.质子数
12.下列有关物质性质的叙述中正确的是 ( )
A.氯化铜浓溶液呈蓝色
B.钠在空气中燃烧产物里阴、阳离子个数比为1:1
C.向饱和Na2CO3溶液中通一定量CO2,一定可以看到浑浊
D.向饱和NaOH溶液中通过量CO2气体,一定会出现浑浊
二、选择题(本题共6小题,每小题4分,共24分,每小题只有一个选项符合题意)
13.下表中物质的分类组合完全正确的是 ( )
| 编号 | 强电解质 | 弱电解质 | 非电解质 |
| A | KNO3 | HF | CO2 |
| B | H2SO4 | CaCO3 | 蔗糖 |
| C | BaSO4 | HClO | H2O |
| D | H2O | NH3 ·H2O | 乙醇 |
14.有甲、乙、丙、丁四只集气瓶中分别装有Cl2、H2、HCl、HBr中的一种气体,甲、丁两瓶气体混和后见光会发生爆炸,甲、乙两瓶混和后,瓶壁上可见暗红色小液滴。则乙瓶中的气体是( )
A. HBr B.HCl C.H2 D.Cl2
15.若a克某气体中含有的分子数为b,则c克该气体在标准状况下的体积是(式中的NA为阿佛加德罗常数) ( )
A.![]() L
B.
L
B.![]() L
C.
L
C.![]() L
D.
L
D.![]() L
L
16.可用于鉴别铁、木炭、氧化铜、二氧化锰的一种试剂是 ( )
A.H2SO4 B.稀HCl C.浓HCl D.氯水
17.两种金属组成的混合物50克,与足量氯气反应,共用去氯气71克,则该混合物可能的组成是
A.锌和铜 B.钙和铜 C.钠和铝 D.铝和铁
18.生活中遇到的问题,常常涉及到化学知识,下列分析中不正确的是 ( )
A.为消除碘缺乏病,卫生部规定食盐必须加碘,所加的碘以单质的形式存在
B.碳酸氢钠的俗名叫小苏打,是生产糕点中发酵粉的主要成分,在医疗上可用于治疗胃酸过多
C.环卫工作人员夏天向马路洒水时,常常在洒水车中的水里加入适量的CaCl2,可使道路较长时间保持湿润
D.市售的“84消毒液”的有效成分是NaClO溶液,可用来对水果、餐具进行消毒
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 | ||||
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | ||||
| 得分 | |||||||||||
第Ⅱ卷(非选择题,共60分)
三、(本题共两小题,共19分)
19.(8分)实验室需要配制100mL2mol·L-1NaCl溶液。
⑴配制上述溶液所需NaCl 固体的质量为 。
⑵配制溶液过程中,除天平(包括砝码)外,还需用到的仪器有 __________________
______________________ 。
⑶如果在配制过程中有如下情形发生时,所配制的溶液的浓度偏高的有 _________ 。
A.向容量瓶中转移溶液时,不小心有少量液体洒出
B.配制溶液的烧杯移液后未用蒸馏水洗涤
C.定容时,俯视容量度瓶刻度线与凹液面最低处相切
D.定容时,仰视容量度瓶刻度线与凹液面最低处相切
20.(11分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
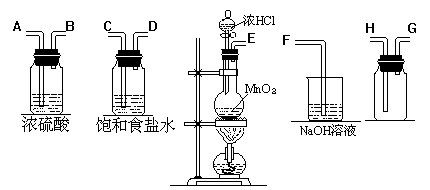
(1)连接上述仪器的正确顺序是(填各接口处的字母):___接___,___接___,___接___,____接____。
(2)在装置中
①饱和食盐水起的作用是 ,
②浓硫酸起的作用是 ,
③NaOH 溶液的作用是 。
(3)写出下列化学反应的离子方程式:
气体发生装置中进行的反应__
(4)使浓盐酸与足量的MnO2共热制氯气,实际产生的氯气总比理论值低,其主要原因是
。
四、(本题包括两小题,共14分)
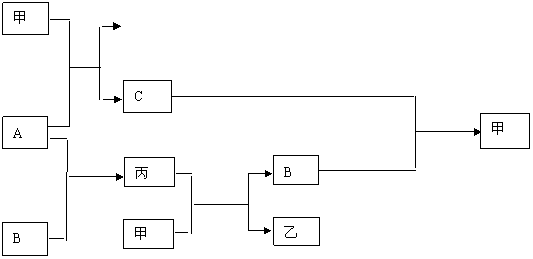
21.(6分)在一定条件下,单质A、B、C与化合物甲、乙、丙之间存在如下变化关系:
![]()
点燃
点燃
已知A的焰色反应呈黄色,B和C是两种气体。试写出它们的化学式:
A: B: C:
甲: 乙: 丙:
22.(8分)A、B、C、D分别是HCl 、BaCl2、AgNO3、Na2CO3 四种物质的无色溶液中的
某一种,先将它们两两混合,产生现象如下表所示:
| 反应物 | A+B | C+D | A+D | C+A | D+B |
| 现 象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
由上表可知:A、B、C、D依次是(填写化学式)
A: B: C: D:
五、(本题包括两小题,共13分)
23.(6分)已知:RO3n-和I-发生反应:RO3n-+6I-+6H+==R-+3I2+3H2O
(1)RO3n-中R元素的化合价为: 价;
(2)R原子最外层电子数为 个。
24.(7分)一定量的液态化合物XY2,在一定量O2 中恰好完全反应:
XY2(l)+3O2(g)=XO2(g)+2YO2(g)
冷却后,在标准状况下,测得生成物的体积为672mL,密度为2.56g·L-1,则:
⑴反应前O2 的体积是 mL。
⑵化合物XY2的摩尔质量是 。
⑶在XY2分子中,X、Y两元素质量比为3:16 ,则X、Y两元素分别为 和
(写元素名称)。
六、(本题包括两小题,共14分)
25.(7分)标准状况下,用一定量的水吸收HCl气体后制得浓度为11.8mol·L-1、密度为
1.18g·cm-3的盐酸。试计算1体积吸收多少体积的HCl气体可制得上述盐酸。(本题中
HCl的式量以36.5计,水的密度以1.00g·cm-3计)
26.(7分)将6.38gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加34.7mL1.00mol·L-1
AgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生135mL(标准状况)
气体。计算原混合物中NaCl的质量分数。
高一化学试题参考答案
一、二大题1——18小题选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | A | C | C | B | B | A | D | D | A | D | A | A | B | C | B | A |
三、
19.(1) 11.7g (2分)
(2) 烧杯、玻璃棒、100mL容量瓶、胶头滴管 (各1分,共4分)
(3) C (2分)
20.(1) E接C,D接A,B接H,G接F。 (3分)
(2) ①除去(或吸收)混在Cl2 中的HCl 气体 (1分)
②除去(或吸收)混在Cl2 中的水蒸气 (1分)
③吸收多余的氯气,防止直接排入大气污染环境 (1分)
(3) MnO2 + 4H+ +
2 Cl- ![]() Mn2+ +Cl2 ↑+2H2O (3分)
Mn2+ +Cl2 ↑+2H2O (3分)
(4)随着反应的进行,浓盐酸的浓度逐渐减小,稀盐酸与MnO2共热不能得到Cl2 (2分)
四、
21. A: Na B: O2 C:H2
甲: H2O 乙: NaOH 丙: Na2O2 (各1分,共6分)
22. A:AgNO3 B:HCl C:BaCl2 D:Na2CO3 (各2分,共8分)
五、
23. (1)+5 (3分)
(2)7 (3分)
24. (1)672 (2分)
(2)76g·mol-1 (3分)
(3)碳 硫 (各1分,共2分)
六、
25. 取1L溶液为分析对象。 (1分)
1L这种盐酸的质量为m(盐酸)=1.18g·cm-3×1000cm3== 1180g (1分)
1L这种盐酸中溶质HCl的质量m(HCl)=11.8mol×36.5g·mol-1== 431g (1分)
1L这种盐酸中溶剂H2O的质量m(H2O)=1180g-431g= 749g 体积V(H2O)=0.479L (1分)
11.8molHCl气体在标准状况下的体积V(HCl)=11.8mol×22.4L·mol-1==264L (1分)
1体积水吸收HCl气体的体积为264L∕0.749L == 352 (1分)
答:1体积水吸收352体积HCl气体(标准状况)。 (1分)
26.发生的反应有
NaCl+AgNO3=AgCl↓+NaNO3
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
Ag2CO3+2HNO3=2AgNO3+H2O+CO2↑ (2分)
反应的关系式有
Na2CO3 —— 2AgNO3 —— Ag2CO3 —— CO2
2mol 22.4L
Xmol 0.135L
X==0.0121 (2分)
NaCl 所用AgNO3 的物质的量为:0.0347L×1.00mol·L-1—0.0121mol== 0.0226mol
NaCl + AgNO3 == AgCl↓+ NaNO3
58.5g 1mol
Yg 0.0225mol
Y== 1.32g (2分)
氯化钠的质量分数为 :1.32g∕6.38g ×100%== 20.7% (1分)