高一化学第一学期期末终结性测试卷
可能用到的相对原子质量:H~1 He~4 C~12 O~16 Na~23 P~31 S~32 Cl~35.5 Br~80 Ag~108 Ba~137
一、选择题(本大题共有16个小题,每小题3分,共48分)每小题只有一个选项符合题意,请将正确选项的序号填入第2页末的答题表的相应空格内。
1、下列情况不会造成环境污染的是
A.燃烧液化石油气 B.燃烧管道煤气
C.燃烧氢气 D.燃烧木材
2、下列离子方程式中,书写正确的是
A.钠与水反应:![]() =======
=======![]()
B.碳酸氢钠溶液与盐酸混合:![]() ========
========![]()
C.氯气溶于水:![]() =======
=======![]()
D.硫酸铜溶液与氢氧化钠溶液混合:![]() =======
=======![]()
3、下列各组中的离子能在溶液中大量共存的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4、已知煤油的密度是0.8g/cm![]() ,根据金属钠的保存方法和与水反应的现象,推测金属钠的密度是
,根据金属钠的保存方法和与水反应的现象,推测金属钠的密度是
A.大于1.0
g/cm![]() B.小于1.0 g/cm
B.小于1.0 g/cm![]()
C.大于0.8g/cm![]() 小于1.0 g/cm
小于1.0 g/cm![]() D.无法推测
D.无法推测
5、有关物质的用途中,利用了氧化还原反应原理的是
A.用氯气消毒自来水 B.用食盐腌渍食物
C.用稀盐酸除去热水瓶内胆壁上的水垢(主要成分为碳酸钙)
D.用小苏打治疗胃酸过多
6、下列说法正确的是
A.卤素单质都是有颜色的,且颜色从![]() 逐渐加深
逐渐加深
B.碱金属单质都是银白色金属,而且密度从![]() 逐渐减小
逐渐减小
C.卤素单质的氧化性从![]() 逐渐增强
逐渐增强
D.碱金属单质的熔沸点按![]() 的顺序逐渐降低
的顺序逐渐降低
7、同浓度的下列物质中导电能力最弱的是
A.氢氧化钠溶液 B.醋酸溶液 C.盐酸溶液 D.醋酸铵溶液
8、下列说法错误的是
A.![]() 比
比![]() 易溶于水
易溶于水
B.![]() 比
比![]() 热稳定性强
热稳定性强
C.石灰水能与![]() 反应,也能与
反应,也能与![]() 反应
反应
D.与足量酸反应得到相同质量![]() 时,所用
时,所用![]() 比
比![]() 的质量多
的质量多
9、设![]() 为阿伏加德罗常数,下列说法中正确的是
为阿伏加德罗常数,下列说法中正确的是
A.18克![]() 含有的原子数目为5
含有的原子数目为5![]()
B.2.3克钠变为![]() 时失去电子数目为0.2
时失去电子数目为0.2![]()
C.![]() 个
个![]() 分子和
分子和![]() 个
个![]() 分子质量相等
分子质量相等
D.标准状况下,22.4升H2 O含有![]() 个水分子
个水分子
10、下列叙述中,正确的是
A.![]() 的摩尔质量是49g
的摩尔质量是49g
B.在标准状况下,1mol任何气体所占的体积都约为22.4L
C.等质量的![]() 和CO中所含的碳原子个数相等
和CO中所含的碳原子个数相等
D.将98g![]() 溶解于500mL水中,所得溶液中
溶解于500mL水中,所得溶液中![]() 溶液的物质的量浓度为2 mol/L
溶液的物质的量浓度为2 mol/L
11、标准状况下,将a L氯化氢气体溶于1000g水中,得到盐酸密度为![]() ,则该盐酸的物质的量浓度是
,则该盐酸的物质的量浓度是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12、同温同压下,等质量的下列气体体积最大的是
A.CO B.HBr C.He D.Cl![]()
13、 分离固体食盐和碘单质混合物的最佳方法是
A.溶解、过滤 B.溶解、加入CCl![]()
C.溶解、加入AgNO![]() 溶液、过滤 D.升华
溶液、过滤 D.升华
14、下列含氯的化合物中,氯元素的化合价最高的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15、下列有关氯气的叙述,其中说法正确的是
A.氯气是无色无味的气体 B.氯气与石灰乳作用可制得漂白粉
C.氯气是由科学家戴维发现的 D.氯气可使干燥的有色布条褪色
16、当足量的Cl![]() 或盐酸分别与下列金属反应时,均有M Cl
或盐酸分别与下列金属反应时,均有M Cl![]() 型化合物生成的是
型化合物生成的是
A.Fe B.Cu C.Mg D.Ag
答 题 表
一、选择题(16×3=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
班级 学号 姓名 总分
二、填空题(本题包括4小题,共17分)
17、(5分)卤族元素包括 等元素(用元素符号表示,下同),其中
元素,具有放射性,在自然界中的含量也很少。卤族元素原子结构上的共同特点是 。大自然中稳定的卤族元素(砹除外)中,氧化性最强的单质是 ,还原性最强的阴离子是 。
18、(4分)在钠及其重要化合物中,日常生活里用于调味和腌菜的是(填化学式,下同)
,常用作洗涤剂的是 ,用于食品工业作为发酵粉成分的是 ,用于呼吸面具的是 。
19、(6分)山区某工厂,在山坡坑道的仓库里贮有氯气钢瓶。某一天,一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施。请选择填充并简述理由。
(1)处理钢瓶的正确方法是 。
(A)把钢瓶推到山坡下小河里 (B)把钢瓶丢到深坑里,用石灰填埋
(C)把钢瓶扔到农田里
简述理由 。
(2)钢瓶处理后,工人转移的方法正确的是 。
(A)转移到坡上 (B)转移到坡下
简述理由 。
20、(2分)成年男子的肺活量约为3500mL—4000mL,成年女子的肺活量约为2500mL—3500mL,肺活量较大的男子与肺活量较小的女子所容纳的物质的量之比(同温同压)是
。
三、推断题(共6分)
21、(6分)右图中A、B、C、D是含氯元素的单质或化合物,具有如图所示的变化关系,其中B是漂白粉的主要成分之一。
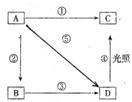
(1)试推断并写出指定物质的化学式
A D
(2)写出指定反应的化学方程式或离子方程式:
反应③的化学反应方程式
反应④的化学反应方程式 B
四、实验题(本题包括2小题,共16分)
22、(6分)现用质量分数为98%、密度为1.84 g/cm![]() 的浓
的浓![]() 来配制500mL、0.2mol/L的稀硫酸,可供选择的仪器有①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒
⑥容量瓶 ⑦托盘天平 ⑧药匙
来配制500mL、0.2mol/L的稀硫酸,可供选择的仪器有①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒
⑥容量瓶 ⑦托盘天平 ⑧药匙
请回答下列问题
(1)上述仪器中,在配制稀![]() 时用不到的仪器是
(填序号)。
时用不到的仪器是
(填序号)。
(2)经计算,需浓![]() 的体积为
mL,
的体积为
mL,
应选用的量筒是 (可供选择的量筒有①10 mL,②50mL,③100mL三种规格)
(3)在配制过程中,下列操作可能会使结果偏高的是
a.未等稀释后的![]() 溶液冷却至室温就转移到容量瓶中
溶液冷却至室温就转移到容量瓶中
b.转移前,容量瓶内有少量蒸馏水
c.定容时,俯视刻度线
d.定容时,仰视刻度线
23、(10分)实验室里用下图所示的实验装置制取纯净的无水![]() 。回答下列问题:
。回答下列问题:
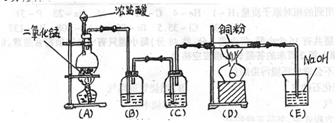
(1)实验前检查整套装置的气密性的方法是
。
(2)装置(A)中发生反应的化学方程式是 。
(3)装置(B)的广口瓶中盛 (写名称),其作用是 。
装置(C)的广口瓶中盛 (写名称),其作用是 。
(4)写出E中发生反应的化学方程式 。
五、计算题(本题包括2小题,共13分)
24、(4分)在200mL 0.5mol/L CuCl![]() 溶液中滴入足量的AgNO
溶液中滴入足量的AgNO![]() 溶液,生成沉淀的质量是多少?
溶液,生成沉淀的质量是多少?
25、(9分)取50mL![]() 和
和![]() 的混合溶液,加入足量
的混合溶液,加入足量![]() 溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
(1)原混合溶液中![]() 和
和![]() 的物质的量浓度;
的物质的量浓度;
(2)产生的气体在标准状况下的体积。
参考答案及评分意见:
一、选择题(16×3=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | C | C | A | D | B | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | B | D | B | D | C | B | C |
二、填空题(共17分)
17、(5分)F、Cl、Br、I、At;At;最外层都有7个电子;![]()
18、(4分)NaCl;![]()
19、(6分)①B,因为泄漏的氯气会与石灰发生反应可防止氯气扩散。(3分)
②A,因为氯气密度比空气大,易向坡下扩散,在坡上相对较安全。(3分)
(意思表达正确即可给分)
20、(2分)8:5
三、推断题(6分)
21、(1)Cl![]() ;HClO(2分)
;HClO(2分)
(2)![]() ======
======![]()
![]() (4分)
(4分)
四、实验题(16分)
22、(6分)(1)②⑦⑧ (1分)
(2)5.4mL(2分);①(1分)
(3)a、c(2分)
23、(10分)
(1)按图示装好仪器,在烧杯中盛半杯水,然后在烧瓶底部稍加热,若在烧杯中的导管口有气泡冒出,且停止加热后,导管口形成一段水柱,表明整套装置不漏气。(2分)
(2)4HCl(浓)![]() (2分)
(2分)
(3)饱和食盐水,除去混在Cl![]() 中的HCl
中的HCl
浓![]() ,除去混在Cl
,除去混在Cl![]() 中的水蒸汽
(每空1分,共4分)
中的水蒸汽
(每空1分,共4分)
(4)![]() =======
=======![]() (2分)
(2分)
五、24、(4分)解:设生成沉淀质量为m(AgCl)
![]() ===========
===========![]()
1 2
0.2L×0.5mol/L=0.1mol ![]() ………………(2分)
………………(2分)
![]()
![]()
=28.7(g)……………………(2分)
答:生成沉淀的质量为28.7克.
25、(9分)解:(1)设原混合溶液中![]() 和
和![]() 的物质的量浓度分别是c(
的物质的量浓度分别是c(![]() )和c(
)和c(![]() )
)
![]() ==================
==================![]()
1 1
c(![]() )
)![]()
![]()
c(![]() )=0.40mol/L…………………………(3分)
)=0.40mol/L…………………………(3分)
![]() ==================
==================![]()
1 1
c(![]() )
)![]()
![]()
c(![]() )=1.0mol/L……………………(3分)
)=1.0mol/L……………………(3分)
(2)设生成的气体在标准状况下的体积为V![]()
![]() ============
============![]()
![]()
![]()
V(![]() )=1.12L……………………(3分)
)=1.12L……………………(3分)
答:略。