高一化学第一学期期末终结性测试体
可能用到的相对原子质量:Mg:24 S:32 N:14 Al:27 Na:23 K:39 C:12
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案)
1.下列状态的物质既能导电,又属于电解质的物质是
A.NaCl晶体 B.铜棒 C.KOH水溶液 D.熔融KCl
2.随着核电荷数的增加,下列关于碱金属元素的说法错误的是
A.它们的熔点和沸点逐渐降低 B.它们的密度逐渐增大
C.它们的原子半径逐渐增大 D.它们的金属性逐渐增强
3.在溶液中离子能共存,加OH-有沉淀析出,加H+有气体放出的一组是
A.HCO3- 、Cl-、Na+、Ca2+ B.Na+、Cu2+、SO42-、Cl-
C.Na+、Ba2+、Cl-、SO42- D.Na+、K+、CO32-、Cl-‑
4.下列离子方程式正确的是
A.在NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B.氧化钠与盐酸反应:O2-+2H+==H2O
C.用NaOH溶液吸收少量CO2:OH-+CO2==HCO3-
D.NaHCO3溶液与稀H2SO4反应:CO32-+2H+==H2O+CO2↑
5.设NA代表阿伏加德罗常数,下列说法正确的是
A.2.3g金属钠变成钠离子时失去的电子数目为0.2NA
B.2g H2所含原子数目为NA
C.17g NH3所含的电子数为10NA
D.11.2L氧气含有的原子数目为NA
6.由Na、Mg、Al三种金属中的两种组成的混合物共10g,跟足量的盐酸反应,产生5.6L标态氢气,则此混合物中必定含有
A.Al B.Mg C.Na D.都不可能含有
7.将钠和钠在空气中燃烧产物X分别加到足量的水中,生成的两种气体在一定的条件下恰好完全反应,则钠与其燃烧产物X的物质的量比为
A.23:78 B.1:1 C.2:1 D.46:78
8.在一定温度下向足量饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静置最终得到的晶体
A.等于1.06g B.大于1.06g,小于2.86g C.等于2.86g D.大于2.86g
9.对于反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂 B.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5:1
C.当有3molCl2参加反应时,有5mole-发生转移 D.氧化剂得电子数与还原剂失电子数之比为1:5
10.当物质的量浓度相同的NaCl、MgCl2和AlCl3三种溶液中所含的Cl-的个数比为1:1:1时,则这三种溶液的体积比应是
A.2:3:6 B.1:2:3 C.3:2:1 D.6:3:2
11.已知VmL Al2(SO4)3溶液中含有Al3+ ag,取出mL溶液稀释到4VmL,则稀释后溶液中SO42-的物质的量浓度为
A.mol·L-1 B.mol·L-1 C.mol·L-1 D.mol·L-1
12.下列说法正确的是
A.H2SO4的摩尔质量是98 B.在标态下,任何物质的摩尔体积都约是22.4L
C.1molN2的质量是28g D.铁原子的摩尔质量等于铁的相对原子质量
13.t℃时,相对分子质量为A的某盐(不含结晶水)饱和溶液,其物质的量浓度为Bmol·L-1,密度为ρg·cm-3,质量分数为a%,溶解度为Sg。下列关系中不正确的是
A.a%=×100% B.S=×100%
C.B= D.1000ρa%=AB
14.2.8gCO和H2组成的混合气体与足量O2充分燃烧后,立即通过足量的Na2O2固体,则固体质量增重
A.小于2.8g B.等于2.8g C.大于2.8g D.无法确定
15.要将30mL0.1mol·L-1的Na2SO3溶液氧化成为Na2SO4,需要 1.2×10-3mol的氧化剂[XO(OH)2]+。则X在还原产物中的最终价态是
A.0 B.+1 C.+2 D.-1
16.下列关于钠的化合物的用途正确的是
A.氧化钠常用来漂白纸浆、草帽辫等 B.过氧化钠常用在呼吸面具和潜水艇里作为氧气的来源
C.小苏打广泛用在玻璃、造纸等工业上 D.烧碱在医疗上用作治疗胃酸过多的药剂
二、填空题(本题共4小题,共25分)
17.(4分)在标态下,①4g氢气,②11.2LO2,③1mLH2O中,所含分子数最多的是(填序号,下同)__________,含原子数最少的是______________,质量最大的是_____体积最大的是________。
18.(6分)通常利用饱和NaHCO3溶液来除去混在CO2中的少量HCl气体,其反应的离子方程式为_________________________;不能用NaOH溶液的原因(用离子方程式表示)_______________________;也不能用饱和Na2CO3溶液,其原因(用离子方程式表示)______________________________。
19.(6分)在0℃ 101kPa下,有CH4和NH3两种气体。⑴若二者体积相同,则分子数之比为______;密度之比为______;氢原子数之比为______;质量之比为_____。
⑵当二者所含氢原子个数相等时,则它们的体积之比为_____;若两种气体按此体积比混合时,所得混合气体在相同条件下对H2的相对密度为_____。
20.(9分)呼吸面具中有Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2,也能吸收CO2生成碳酸盐和氧气。
⑴写出KO2与CO2反应的化学方程式________________________________
⑵1kgNa2O2和1kgKO2分别与足量的CO2反应生成O2的质量为(保留3位有效数字)________kg和_______kg。
⑶你认为选用____作吸收剂更合适,理由是__________________________________________________________。
三、推断题(共7)
 21.(7分)A、B、C是由常见元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系:
21.(7分)A、B、C是由常见元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系:
完成下列空白:
⑴在A、B、C这三种化合物中,必定含有的元素是_______;(用甲、乙、丙字母表示)
⑵A、B、C的化学式分别为______、______、______;
⑶单质甲与化合物B反应的离子方程式___________________________________。
四、实验题(本题包含2小题,共12分)
22.(6分)现用质量分数为98%、密度为1.84g·cm-3的浓H2SO4来配制500mL、0.2mol·L-1的稀H2SO4。请回答下列问题(填代号):
⑴现有下列仪器:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。上述仪器中,在配制稀H2SO4时用不到的是(填序号)________________。
⑵下列操作中:①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中;②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中;③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4;④定容时,加蒸馏水超过标线,又用胶头滴管吸出;⑤转移前,容量瓶中含有少量蒸馏水;⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线;⑦定容时,俯视标线。
错误的有__________,其中能引起误差偏高的操作有__________________。
23.(6分)现有一定量含有 Na2O杂质的 Na2O2试样,请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,稀盐酸和蒸馏水)。
请填写下列空白: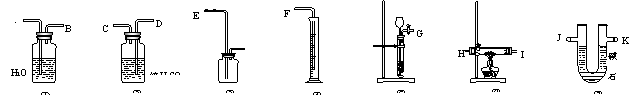
⑴写出在该实验中Na2O2发生反应的化学方程式___________________________
⑵应选用的装置是(只要求写出图中装置的代号)________________________
⑶所选用装置的连接顺序是(填各接口的字母,连接胶管省略)________________________
五、计算题(共8分)
24.(8分)标态下,用一定量的水吸收氨气后制得浓度为12.0mol·L-1,密度为0.915g·cm-3的氨水。试计算:⑴该氨水中溶质的质量分数
⑵1体积水吸收多少体积的氨气可制得上述氨水(氨的相对分子质量以17g·mol-1计,水的密度以1.00g·cm-3计)
附加题(重点中学做)
一、单项选择题(每题3分,共6分)
1.NH4HCO3不稳定,受热分解NH4HCO3![]() NH3↑+H2O+CO2↑,120℃时,若有60%的NH4HCO3分解,则产生的气体的平均相对分子质量是
NH3↑+H2O+CO2↑,120℃时,若有60%的NH4HCO3分解,则产生的气体的平均相对分子质量是
A.17 B.18 C.44 D.
2.已知钾的氧化物有K2O2和KO2,在两种化合物组成的混合物中,钾与氧的质量比为13:8,求混合物中K2O2和KO2的物质的量之比为
A.1:1 B.1:2 C.2:1 D.2:3
二、填空题(每空1分,共6分)
3.(6分)称取一定量的纯碱,溶于水后与盐酸反应,放出CO2,用“增多”或“减少”填空。
⑴若纯碱中含有NaHCO3,则所需盐酸用量______,产生的气体_______;
⑵若纯碱中含K2CO3,则所需盐酸的用量_____,产生的气体________;
⑶若纯碱中含NaOH,则所需盐酸的用量_____,产生的气体___________。
三、计算题(共8分)
4.(8分)将amolNaHCO3和bmolNaOH组成的固体混合物放在密闭容器中加热至250℃,经充分反应后排出气体,冷却后,称量残留固体的质量为mg。试写出a、b取值相对大小不同时,用a、b表示的m的数学表达式:
⑴当_________时,m=______________;
⑵当__________时,m=_______________。
高一化学参考答案及平分标准
一、(每小题3分,共48分)1.D 2.B 3.A 4.A 5.C 6.C 7.C 8.D 9.C 10.D 11.D 12.C 13.C 14.B 15.A 16.B
二、
17.(4分)① ③ ② ①(每空1分,共4分)
18.(6分)HCO3-+H+==CO2↑+H2O; CO2+2OH-==CO32-+H2O; CO32-+H2O+CO2==2HCO3-(每空2分,共6分)
19.⑴1:1 16:17 4:3 16:17 ⑵3:4 8.29(每空1分,共6分)
20.(9分)⑴4KO2+2CO2==2K2CO3+3O2↑(2分) ⑵0.205 0.338(各2分)
⑶KO2(1分);相同质量的KO2和Na2O2,KO2产生的O2更多(2分)
三、
21.(7分)⑴乙(2分);⑵Na2O2、H2O、NaOH(每空1分,共3分)⑶2Na+2H2O==2Na++2OH-+H2↑(2分)
四、
22.(6分)⑴②⑦⑧,⑵①②③④⑥⑦,①②⑦。(每空2分,多选少选都不给分)
23.(6分)⑴2Na2O2+2H2O==4NaOH+O2↑(2分) ⑵⑤①④(2分,多选少选不给分);⑶G接A、B接F(2分,次序错不给分)
五、计算题(共8分)
24.(8分)⑴根据c=,求ω ω===22.3% (3分)
⑵设有1L氨水 V(NH3)=1L×12.0mol·L-1×22.4L·mol-1=268.8L (1分)
水的质量为:1000cm3×0.915g·cm-3-1L×12.0mol·L-1×17g·mol-1=711g (1分)
V(H2O)==0.711L (1分) = ≈378 (2分)
(注:其它正确解法,参照给分)
附加题
一、(6分)1.D 2.B (每小题3分,共6分)
二、3.(6分)⑴减少,增多;⑵减少,减少;⑶增多,减少。(每空1分,共6分)
三、(8分)⑴a≥b (66a+40b)g ⑵a>b 53(a+b)g (每空2分,共8分)