高一化学第一章及第三章知识归纳及模拟训练
二. 教学目标:
1. 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物等重要的基本概念;氧化还原反应中的重要规律以及上述概念、规律的综合应用。
2. 电解质、非电解质、强电解质、弱电解质、离子反应、离子方程式等重要的基本概念;电离的规律,离子反应的类型,离子方程式的书写等规律的综合应用。
3. 以“物质的量”为桥梁进行的有关物质的质量、气体体积、物质的微粒数、物质的量浓度之间的计算。
4. 阿伏加德罗常数问题。溶质的质量分数、溶解度等有关溶液组成的计算。
三. 知识分析:
(一)知识归纳及基本概念
1. 化学反应的分类

2. 氧化还原反应中有关概念及其关系:
![]()
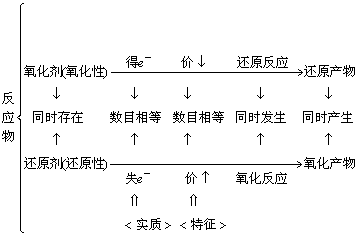 生成物
生成物
3. 电解质
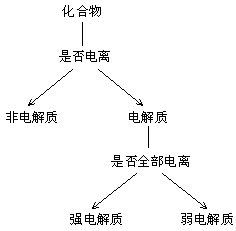
*注:物质电离是需要外界条件的![]()
| 强电解质 | 弱电解质 | ||
| 相同点 | 都能在水溶液或熔化状态下产生离子 | ||
| 不 同 点 | 概念 | 全部电离 | 部分电离 |
| 表示 | 不可逆过程,“ | 可逆过程“ | |
| 粒子的 | 只存在电离生成的 | 存在大量的电解质分子 | |
| 存在形式 | 阴、阳离子,不存在分子 | 少量存在电离产生的阴、阳离子 | |
*注:相关知识包括
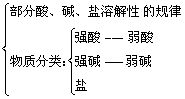
4. 离子反应

5. 物质的量
(二)方法规律
1. 有关氧化还原反应的规律总结
(1)物质氧化性或还原性强弱
① 氧化还原反应发生的方向
氧化剂 + 还原剂![]() 还原产物 + 氧化产物
还原产物 + 氧化产物
强氧化性 + 强还原性![]() 弱还原性 + 弱氧化性
弱还原性 + 弱氧化性
② 金属活动性顺序
![]()
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
![]()
③ 非金属活动性顺序
![]()
F Cl Br I
![]()
(2)氧化还原反应过程中的规律
① 反应顺序:
当一种氧化剂同时遇到了多种还原剂时,还原性最强的首先被氧化
② 电子守恒:
任何氧化还原反应中,氧化剂的得电子总数,一定等于还原剂的失电子总数。
③ “邻位不反应”规律
具有相邻价态的同种元素间不发生氧化还原反应。
④ “化合价不交叉”规律
具有不同价态的同种元素反应时,该元素的化合价不能交叉换位。
(三)有关离子反应规律的总结
1. 判断离子方程式书写是否正确的方法——六查
查反应本质、查物质拆分、查三个守恒(原子、电荷、电子)
查条件符号、查离子比例、查量的关系。
2. 离子间不能共存的原因:

*注:
(1)关于离子间不能共存的规律,我们还将在今后的学习中进一步完善。
(2)已知条件中特别提到颜色时,决定了某些离子不能存在:![]() (黄)、
(黄)、![]() (黄)、
(黄)、![]() (紫)。
(紫)。
【典型类型题】
(一)氧化还原反应
1. 基本概念的考查
[例1] 按要求完成下列反应方程式,用线桥标出反应的电子转移情况,注明氧化剂和还原剂。
(1)水既作氧化剂,又作还原剂 ;
(2)硫酸做氧化剂 ;
(3)氧气氧化某种非金属单质 ;
(4)非金属氧化物作还原剂 。
解析:紧扣概念:氧化剂![]() 得
得![]()
![]() 价
价![]() 、还原剂
、还原剂![]() 失
失![]()
![]() 价
价![]() ;熟悉反应原理,对号入座。
;熟悉反应原理,对号入座。
答案: 氧化剂 还原剂
![]()
![]()
(1)![]()
![]()
![]()
![]()
![]()
(2)![]() (稀)
(稀)![]()
![]()
![]()
![]()
(3)![]()
![]()
![]()
![]()
(4)![]()
![]()
![]()
2. 反应规律的考查
[例2] 在![]() 的反应中,当有
的反应中,当有![]() 电子发生转移,被氧化的氯原子与被还原的氯原子的原子个数比为( )
电子发生转移,被氧化的氯原子与被还原的氯原子的原子个数比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
分析:此题关键是弄清氧化剂![]() 中+5价的氯在还原产物中的价态,有下面两种结果
中+5价的氯在还原产物中的价态,有下面两种结果
得![]()
![]() (1)
(1)![]() 错
错
失![]()
得![]()
![]()
![]() (2)
(2)![]() 对
对
失![]()
(1)错在违背了化合价不交叉的规律,在分析清楚被氧化与被还原的氯原子后,即可得出正确答案。
答案:C
3. 氧化性(还原性)强弱的比较
[例3] 常温下,可以发生下列三个反应:
(1)![]()
(2)![]()
(3)![]()
由此得出的正确结论是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 中
中![]() 还原性最强
还原性最强
B. ![]() 、
、![]() 、
、![]() 、
、![]() 中
中![]() 氧化性最弱
氧化性最弱
C. ![]() 不能向右进行
不能向右进行
D. 还原性![]()
解析:氧化还原反应发生的方向为:强氧化剂+强还原剂![]() 弱氧化剂+弱还原剂。
弱氧化剂+弱还原剂。
答案:C
4. 典型计算
[例4] ![]() 离子在一定条件下可以把
离子在一定条件下可以把![]() 离子氧化为
离子氧化为![]() ,若反应后
,若反应后![]() 变为
变为![]() 离子,且反应中氧化剂与还原剂的物质的量之比为
离子,且反应中氧化剂与还原剂的物质的量之比为![]() ,则
,则![]() 值( )
值( )
A. 4 B. 3 C. 2 D. 1
分析:氧化还原反应的计算多数不必书写完整的化学方程式,只要抓住“氧化剂得电子总数=还原剂失电子总数”这一守恒规律,即可判断有关元素的化合价。
答案:![]() :得
:得![]()
![]() :失
:失![]()
![]()
![]() 即
即![]() 2
2
(二)离子反应:
1. 概念辨析的考查
[例5] 有下列物质① 石墨;②
铜丝;③ 氧气;④ ![]() ;⑤ 食盐;⑥ 稀
;⑤ 食盐;⑥ 稀![]() ;⑦ 水;⑧
;⑦ 水;⑧ ![]() ;⑨ 金刚石,以下叙述正确的是( )
;⑨ 金刚石,以下叙述正确的是( )
A. 能导电的有①②⑤⑦ B. 属于电解质的有⑤⑥⑦⑧
C. 属于强电解质的有⑤⑧ D. ①②③⑨既不是电解质又不属于非电解质
分析:A. 弄清能导电与能电离的关系;B. 电解质务必属于化合物(纯净物);C. 分清能溶与能电离的差异;D. 非电解质也必须是化合物。
答案:C、D
2. 离子方程式书写的考查
[例6] 判断下列离子方程式书写是否正确,如不正确请更正:
(1)![]() 与
与![]() 反应:
反应:![]()
(2)![]() 与稀
与稀![]() 反应:
反应:![]()
(3)实验室用![]() 和
和![]() 制
制![]() :
:![]()
(4)![]() 溶液与稀
溶液与稀![]() 反应:
反应:![]()
(5)过量![]() ,通入少量
,通入少量![]() 溶液中:
溶液中:![]()
(6)![]() 溶液与
溶液与![]() 反应:
反应:![]()
分析:
(1)拆分错误:![]() 为弱电解质。
为弱电解质。
(2)原理错误:生成![]()
(3)不能书写离子方程式
(4)比例错误:![]() 应带有
应带有![]() 、
、![]() 也是
也是
(5)量的错误:少量![]() 与过量
与过量![]() 反应生成
反应生成![]()
(6)电荷不守恒:反应前3+,反应后4+
答案:
(1)![]()
(2)![]()
(3)无法书写
(4)![]()
(5)![]()
(6)![]()
3. 电荷守恒的考查
[例7] 在一定条件下,![]() 和
和![]() 发生反应的离子方程式如下:
发生反应的离子方程式如下:![]()
![]() 。
。
(1)![]() 中R元素的化合价是
。
中R元素的化合价是
。
(2)R元素的原子最外层的电子数是 。
分析:
(1)离子方程式“![]() ”号两边电荷总数应相等,由此,可知
”号两边电荷总数应相等,由此,可知![]() ,则
,则![]() 中R应为+5价。
中R应为+5价。
(2)题中由![]() 可知R为+5价,又由
可知R为+5价,又由![]() 可知R为
可知R为![]() 价,需要同学们对于非金属元素正、负价的成因有一定的了解,去除干扰项+5价,可知R最外层的电子数为7。
价,需要同学们对于非金属元素正、负价的成因有一定的了解,去除干扰项+5价,可知R最外层的电子数为7。
答案:(1)+5 (2)7
4. 离子共存的考查
[例8] 在![]() 和
和![]() 的无色透明溶液中,都能大量共存的离子组是( )
的无色透明溶液中,都能大量共存的离子组是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() B.
B.
![]() 、
、![]() 、
、![]() 、
、![]()
C. ![]() 、
、![]() 、
、![]() 、
、![]() D.
D.
![]() 、
、![]() 、
、![]() 、
、![]()
分析:认真审题,提炼条件:![]() (酸性)、
(酸性)、![]() (碱性)、无色、共存。
(碱性)、无色、共存。
A. ![]() 与
与![]() 、
、![]() 发生氧化还原反应
发生氧化还原反应
B. ![]() 与
与![]() 生成
生成![]()
D. ![]() 紫色,
紫色,![]() 与
与![]() 生成
生成![]() 沉淀
沉淀
答案:C
(三)物质的量有关计算
1. 基本概念的计算
[例9] 设![]() 为阿伏加德罗常数,下列说法不正确的是( )
为阿伏加德罗常数,下列说法不正确的是( )
A. 常温常压下,11.2L氮气所含的原子数目为![]() 。
。
B. 活泼金属从盐酸中置换出![]() ,电子转移数为
,电子转移数为![]() 。
。
C. ![]()
![]()
![]() 溶液中,
溶液中,![]() 的浓度为
的浓度为![]() 。
。
D. 在标准状况下,0.5NA个氧气分子所占的体积是11.2L。
分析:此题对物质的量的求算,从多方面进行考查,这里介绍一个涉及物质的量的“万能恒等式”,该恒等式在解答有关物质的量、物质的量浓度、摩尔质量、物质质量、气体体积、粒子数以及阿伏加德罗常数的问题可以有条不紊。为:
![]()
答案:A
2. 阿伏加德罗定律推论的考查
[例10] 氢气和氧气的混合气体,在120℃和一定压强下体积为![]() ,点燃后发生反应,待恢复至原来温度和压强时,测得其体积为
,点燃后发生反应,待恢复至原来温度和压强时,测得其体积为![]() 。原混合气体中氢气和氧气的体积各是多少升?
。原混合气体中氢气和氧气的体积各是多少升?
解析:这是根据阿伏加德罗定律进行讨论计算的能力考查题,比较快速的解法是“差量法”。
答案:
解:设参加反应的![]() 体积为
体积为![]() ,
,![]() 体积为
体积为![]()
![]() (气)
(气) ![]()
2 1 2 1
x y
![]()
![]()
![]()
情况一:当![]() 与
与![]() 恰好完全反应时:
恰好完全反应时:
![]()
![]()
情况二:当![]() 过量时,
过量时,![]() 全部参加反应:
全部参加反应:
![]()
![]()
情况三:当![]() 过量时,
过量时,![]() 全部参加反应
全部参加反应
![]()
![]()
3. 关于天平平衡问题的讨论
[例11] 在托盘天平两盘上,各放有一杯等浓度、等质量的稀![]() ,调节天平平衡后,往各杯内放入等质量的
,调节天平平衡后,往各杯内放入等质量的![]() 和
和![]() ,使其充分反应后,如果有如下情况时,天平是否保持平衡。
,使其充分反应后,如果有如下情况时,天平是否保持平衡。
(1)两边金属都完全反应而溶解,天平是否平衡?
(2)两边金属都有剩余,天平是否平衡?
(3)其中一杯中金属有剩余,则剩余的金属是什么?天平是否平衡?
分析:天平平衡问题的解题思路——抓本质,即烧杯内增重是否一样!酸和金属相对量可有下列三种情况:
(1)酸完全反应,放出气体相同。
A. 加入物,质量相等![]() 天平仍平衡
天平仍平衡
B. 加入物,物质的量相等,质量不等![]() 天平不平衡
天平不平衡
(2)酸过量,金属完全反应。
A. 加入物,质量相同,放出气体不同![]() 天平不平衡。
天平不平衡。
B. 加入物,物质的量相同,质量不等,放出气体不一定相同,要考虑增重是否相等。(金属价态不同造成)
(3)加入的一种金属过量,另一种金属量不足。
A. 加入相同质量的两种物质,放出气体不同,天平不平衡。
B. 加入物质的量相同,要考虑增重是否相等。
答案:明确反应物与生成物的量的关系:
![]() (稀)
(稀)![]()
![]() (稀)
(稀)![]()
设每杯内各有![]() ,
,![]()
![]() ,由方程式可知:
,由方程式可知:
(1)两种金属都溶解时,两边放出氢气分别为![]() 和
和![]() ,因
,因![]() ,所以天平不平衡。
,所以天平不平衡。
(2)两种金属都剩余时,说明![]() 量不足,两边放出氢气都是
量不足,两边放出氢气都是![]() ,所以天平平衡。
,所以天平平衡。
(3)若一种金属有余,剩余的一定是![]() ,因为
,因为![]() ,这里有两种情况:
,这里有两种情况:
①
当![]() 时,即
时,即![]() ,
,![]() 刚好溶解完,Fe剩余,两边放出H2都是
刚好溶解完,Fe剩余,两边放出H2都是![]() ,天平平衡。
,天平平衡。
②
当![]() 时,即
时,即![]()
![]() ,则Zn全溶解,Fe有剩余,两边放出H2分别为
,则Zn全溶解,Fe有剩余,两边放出H2分别为![]() 和
和![]() ,则天平不平衡。
,则天平不平衡。
【模拟试题】
一. 填空题:
1. 强电解质和弱电解质的本质区别在于( )
A. 强电解质易溶于水,弱电解质难溶于水
B. 相同浓度时,溶液的导电能力的强弱
C. 在水溶液里电解质是否全部电离为离子
D. 是离子化合物还是共价化合物
2. 在下列物质中,只有在溶液状态中才能导电的电解质是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
3. 已知:
(1)![]() ;
;
(2)![]()
(3)![]()
判断下列物质氧化能力强弱顺序正确的是( )。(杭州市质检题)
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
4. 下列各组离子在水溶液中能大量共存的是( )。(山西省测试题)
A. ![]() 、
、![]() 、
、![]() 、
、![]() B.
B.
![]() 、
、![]() 、
、![]() 、
、![]()
C. ![]() 、
、![]() 、
、![]() 、
、![]() D.
D.
![]() 、
、![]() 、
、![]() 、
、![]()
5. 有一支![]() 酸式滴定管,其中盛有溶液,液面恰好在
酸式滴定管,其中盛有溶液,液面恰好在![]() 刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )。(东华杯竞赛题)
刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )。(东华杯竞赛题)
A. 大于![]() B. 为
B. 为![]() C. 小于
C. 小于![]() D. 为
D. 为![]()
6. 某实验需要![]() 固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
A. 等于8.0g B. 等于8.00g C. 大于8.0g D. 等于0.2g
7. 关于同温、同压下等体积的![]() 和
和![]() 的叙述:① 质量相等;② 密度相等;③ 所含分子个数相等;④ 所含碳原子个数相等,其中正确的是( )。(上海市高考题)
的叙述:① 质量相等;② 密度相等;③ 所含分子个数相等;④ 所含碳原子个数相等,其中正确的是( )。(上海市高考题)
A. ①②③④ B. ②③④ C. 只有③④ D. 只有③
8. 在0℃时,氧气的溶解度为0.049,则在相同状况下100mL水中溶解氧气( )。(西安市竞赛题)
A. 0.0049g B. 0.049g C. 0.49g D. 0.007g
9. 实验中需2mol/L的![]() 溶液
溶液![]() ,配制时应选用的容量瓶的规格和称取
,配制时应选用的容量瓶的规格和称取![]() 的质量分别为( )
的质量分别为( )
A. ![]() ,
,![]() B.
B.
![]() ,
,![]()
C. ![]() ,
,![]() D.
任意规格,572g
D.
任意规格,572g
10. 在标准状况下,112mL气态氮的氧化物的质量为0.38g。该氧化物中氧元素的质量分数是63.10%,则该氧化物的化学式为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
11. 下列一定量的各物质所含原子个数按由大到小顺序排列的是( )。(全国高考题)
① 0.5mol氨气 ② 标准状况下22.4L氦气
③ 4℃时9mL水 ④ 0.2mol磷酸钠
A. ①④③② B. ④③②① C. ②③④① D. ①④②③
12. 化合物AB中含B为33.3%,化合物![]() 中含B为50%,则化合物
中含B为50%,则化合物![]() 中含B为( )。(北京市崇文区测试题)
中含B为( )。(北京市崇文区测试题)
A. 20% B. 25% C. 40% D. 12.5%
13. 取A、B、C三种金属各0.1mol,分别与足量的盐酸反应,在标准状况下,共生成6.72L氢气,又知B、C所产生的氢气的体积比是![]() ,且两者产生氢气的体积之和跟A产生的氢气相等,则在氯化物中A元素的化合价为( )。
,且两者产生氢气的体积之和跟A产生的氢气相等,则在氯化物中A元素的化合价为( )。
A. +1 B. +2 C. +3 D. +4
14. 下列各组溶液,不用其他试剂就可以将它们区别开的是( )。(全国高考题)
A. 盐酸、氢氧化钾、硫酸钾、碳酸钾
B. 硝酸钠、盐酸、氯化镁、氢氧化钾
C. 氯化钡、氯化钙、硫酸钠、硝酸钾
D. 氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
15. 将溶质质量分数为![]() %,物质的量浓度为
%,物质的量浓度为![]() 的
的![]() 溶液蒸发掉一定量的水,使其溶质的质量分数为
溶液蒸发掉一定量的水,使其溶质的质量分数为![]() %,此时物质的量浓度为
%,此时物质的量浓度为![]() 。则
。则![]() 和
和![]() 的关系是( )。(郑州市预测题)
的关系是( )。(郑州市预测题)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
16. 假如把质量数为12的碳原子(![]() )的相对原子质量定为24,并用以确定相对原子质量,以0.024kg
)的相对原子质量定为24,并用以确定相对原子质量,以0.024kg![]() 所含的碳原子数为阿伏加德罗常数,下列数值:①
浓
所含的碳原子数为阿伏加德罗常数,下列数值:①
浓![]() 的物质的量浓度;② 氧气的溶解度;③ 气体摩尔体积;④ 阿伏加德罗常数;⑤ 氧元素的相对原子质量;⑥ 32g
的物质的量浓度;② 氧气的溶解度;③ 气体摩尔体积;④ 阿伏加德罗常数;⑤ 氧元素的相对原子质量;⑥ 32g![]() 在标准状况下的体积。其中肯定不变的是( )。(四川省测试题)
在标准状况下的体积。其中肯定不变的是( )。(四川省测试题)
A. ①② B. ③④ C. ④⑤ D. ②⑥
17. 下列离子方程式错误的是( )。(济南市检测题)
A. ![]() 溶液中滴加足量硫酸:
溶液中滴加足量硫酸:
![]()
B. ![]() 溶液中滴加少量硫酸:
溶液中滴加少量硫酸:
![]()
C. ![]() 溶液中加足量
溶液中加足量![]() 溶液:
溶液:
![]()
D. ![]() 溶液中加少量
溶液中加少量![]() 溶液:
溶液:
![]()
18. ![]() 离子和
离子和![]() 在酸性溶液中发生如下反应( )
在酸性溶液中发生如下反应( )
![]()
则![]() 离子中M的化合价是( )。(武汉市高三调研题)
离子中M的化合价是( )。(武汉市高三调研题)
A. +2 B. +3 C. +4 D. +6
19. 设![]() 为阿伏加德罗常数,下列说法中不正确的是( )
为阿伏加德罗常数,下列说法中不正确的是( )
A. 在常温常压下,11.2L氮气所含的原子数目为![]()
B. 活泼金属从盐酸中置换出1mol![]() ,电子转移数为
,电子转移数为![]()
C. ![]() 、
、![]() 溶液中,
溶液中,![]() 的浓度为
的浓度为![]()
D. 在标准状况下,![]() 个氧气分子所占的体积是
个氧气分子所占的体积是![]()
20. ![]() 浓度为
浓度为![]() 的含
的含![]() 离子的溶液恰好可把
离子的溶液恰好可把![]() 浓度为
浓度为![]()
![]() 的含
的含![]() 溶液中的
溶液中的![]() 离子全部沉淀。
离子全部沉淀。![]() 的值是( )。(普通高校春招考试)
的值是( )。(普通高校春招考试)
A. 4 B. 3 C. 2 D. 1
二. 实验题:
21.(7分)实验室配制![]() 的
的![]() 溶液,有如下操作步骤:
溶液,有如下操作步骤:
① 把称量好的![]() 晶体放入小烧杯中,加适量蒸馏水溶解;②
把①所得溶液小心转入
晶体放入小烧杯中,加适量蒸馏水溶解;②
把①所得溶液小心转入![]() 容量瓶中;③ 继续向容量瓶中加蒸馏水至液面距刻度
容量瓶中;③ 继续向容量瓶中加蒸馏水至液面距刻度![]() ~
~![]() 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④
用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤
将容量瓶塞紧,充分摇匀。
处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④
用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤
将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)本实验用到的基本仪器有 。
(3)某同学观察液面的情况如图3—8所示,对所配溶液浓度有何影响?会 (填“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会
;加蒸馏水时不慎超过了刻度,会 。
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应
;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应 。(济南市测试题)
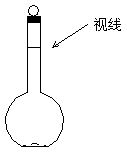
图3—8
22.(8分)现有实验药品:一定质量的锌(分片状和粒状两种)、浓![]() (密度
(密度![]() )、 水以及图3—9所示装置。图中量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水。甲管有刻度(0~100mL),甲、乙管可固定在铁架上,供量气用。乙管可上下移动,以调节液面高低。利用此装置可测定锌的相对原子质量。(设锌全部反应,产生的气体不超过50mL)。回答下列问题:
)、 水以及图3—9所示装置。图中量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水。甲管有刻度(0~100mL),甲、乙管可固定在铁架上,供量气用。乙管可上下移动,以调节液面高低。利用此装置可测定锌的相对原子质量。(设锌全部反应,产生的气体不超过50mL)。回答下列问题:
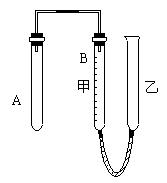
图3—9
(1)实验前为检查装置的气密性,先将A、甲、乙三管固定,乙管中注入水,液面高于甲液面,静置片刻, ,说明装置气密性良好。
(2)按图示装置实验,要保证不漏出![]() ,应如何操作?答: 。
,应如何操作?答: 。
(3)为了准确地测量![]() 的体积,在读取反应后甲管中液面的读数时,应注意
的体积,在读取反应后甲管中液面的读数时,应注意
(填写序号)。
A. 视线与凹液面最低处相平。
B. 等待片刻,待乙管液面不再上升时读数。
C. 读数时应上、下移动乙管,使甲、乙两管液面相平。
D. 读数时不一定使甲、乙两管液面相平。
(4)设计一个不用量气管,而用中学常用仪器测量![]() 体积的装置,应选用的仪器(自选)是 。(北京市西城区抽样测试题)
体积的装置,应选用的仪器(自选)是 。(北京市西城区抽样测试题)
三. 填空题:
23.(8分)X、Y、Z是常见元素的单质,U、V是化合物。它们有如下反应(式中各物质的化学计量数和反应条件均已略去)
①
![]() ②
② ![]() ③
③ ![]()
(1)写出下面所属反应的基本类型:①式属 ;②式属 。
(2)列举符合①式的4个不同类型的实例,写出反应方程式,如果是离子反应,请用离子方程式表示: 、 、 、 。
(3)在(2)中所举实例中,也符合反应②和③的反应是 。
24.(6分)已知物质![]() 在水溶液中离子积为
在水溶液中离子积为![]() ,式中的
,式中的![]() 和
和![]() 表示离子的物质的量浓度。若某温度下
表示离子的物质的量浓度。若某温度下![]() 的溶解度为0.222g,设其溶液密度为
的溶解度为0.222g,设其溶液密度为![]() ,计算:
,计算:
(1)该温度下![]() 饱和溶液的物质的量浓度为 。
饱和溶液的物质的量浓度为 。
(2)该温度下![]() 饱和溶液中
饱和溶液中![]() 的离子积为 。
的离子积为 。
25.(6分)一定质量的液态化合物![]() ,在一定质量的
,在一定质量的![]() 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为:![]() 。冷却后,在标准状况下测得生成物的体积是
。冷却后,在标准状况下测得生成物的体积是![]() ,密度是
,密度是![]() ,则:
,则:
(1)反应前![]() 的体积是 。
的体积是 。
(2)化合物![]() 的摩尔质量是 。
的摩尔质量是 。
(3)若![]() 分子中X、Y两元素的质量比是
分子中X、Y两元素的质量比是![]() ,则X、Y两元素分别为 和
,则X、Y两元素分别为 和
(写元素符号)。(西安市质检题)
26.(4分)1.88g某相对分子质量为117.5的易燃物质![]() 可以自身发生爆炸,生成0.432g水、358.4mL氯化氢、448mL
可以自身发生爆炸,生成0.432g水、358.4mL氯化氢、448mL![]() 和若干克
和若干克![]() (体积均为标准状况下测定)。则此易燃物质的化学式为 ,爆炸反应的化学方程式为 。(北京市崇文区测试题)
(体积均为标准状况下测定)。则此易燃物质的化学式为 ,爆炸反应的化学方程式为 。(北京市崇文区测试题)
27.(6分)常温下,将20g质量分数为14%的氯化钠溶液跟30g质量分数为24%的氯化钠溶液混合,得到密度为1.15g/mL的混合溶液,该溶液中溶质的质量分数为 ,物质的量浓度为 。在100g水中加入 mol氯化钠才能使其浓度与上述混合溶液的浓度相等。
四. 计算题:
28.(6分)20℃时,100mL![]() 的
的![]() 溶液中含有
溶液中含有![]() 未溶的
未溶的![]() 固体。向其中加入1L水,充分搅拌后,未溶固体由
固体。向其中加入1L水,充分搅拌后,未溶固体由![]() 变为
变为![]() 。
。
(1)若温度不发生变化,此时物质的量浓度为 。
(2)若体积不发生变化,此时物质的量浓度为 。
29.(7分)在标准状况下,将224LHCl气体溶于635mL水(![]() )中,所得盐酸的密度为
)中,所得盐酸的密度为![]() 。试计算:
。试计算:
(1)取出这种盐酸![]() ,稀释至1.45L,所得稀盐酸的物质的量浓度。
,稀释至1.45L,所得稀盐酸的物质的量浓度。
(2)在![]() 溶液中,逐滴加入(1)所配制的稀盐酸,边滴边振荡。若使反应不产生
溶液中,逐滴加入(1)所配制的稀盐酸,边滴边振荡。若使反应不产生![]() 气体,加入稀盐酸的体积最多不能超过多少毫升?(北京市朝阳区测试题)
气体,加入稀盐酸的体积最多不能超过多少毫升?(北京市朝阳区测试题)

【试题答案】
一. 选择题:
1. C 2. D 3. C 4. D 5. A 6. C 7. C 8. D 9. A 10. D
11. A 12. A 13. C 14. D 15. C 16. D 17. B 18. D 19. A 20. B
二. 实验题:
21.
(1)①②④③⑤
(2)天平、药匙、烧杯、玻璃棒、![]() 容量瓶、胶头滴管
容量瓶、胶头滴管
(3)偏高 (4)偏低;偏低
(5)宣告实验失败,从头重做;宣告实验失败,从头重做;
22.
(1)液面保持不动
(2)将A试管胶塞打开,加适量水,再沿试管壁慢慢注入少量浓![]() ,液体体积不超过试管容积的1/3,振荡;试管斜放,把锌片放在试管内壁上,塞上胶塞,试管慢慢直立,锌与稀
,液体体积不超过试管容积的1/3,振荡;试管斜放,把锌片放在试管内壁上,塞上胶塞,试管慢慢直立,锌与稀![]() 接触。
接触。
(3)A、C (4)广口瓶,带导管双孔胶塞,量筒
三. 填空题:
23.
(1)置换反应;化合反应
(2)![]()
![]()
![]()
![]()
(3)都不是
24.(1)![]() (2)
(2)![]()
25.(1)![]() (2)
(2)![]() (3)C;S
(3)C;S
26. ![]() ;
;![]()
27. 20%;3.93 mol/L;0.427
四. 计算题:
28.(1)![]() (2)
(2)![]() 或
或![]()
29.(1)![]() (2)
(2)![]()