官道中学06-07学年度上学期期中考试
高一年级化学科试题
时间 100 分钟 满分 100分
(相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cu 64 K 39 )
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意。)
1. “绿色商品”是指对环境无污染的商品,下列属于 “绿色商品”的是( )
A.含氟冰箱 B.含铅汽油 C.含磷洗涤剂 D.含碘食盐
2.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是( )
A、氧化剂 B、还原剂 C、既是氧化剂又是还原剂 D、以上均不是
3.下列物质中,属于弱电解质的是 ( )
A.乙醇 B.醋酸钠 C.硫酸钡 D.水
4、钠原子与钠离子比较,相同的是 ( )
A、核外电子层数 B、最外层电子数 C、能与水反应并放出H2 D、焰色反应
5、物质在化学反应前后,一定发生变化的是 ( )
A、反应前后的总能量 B、各元素的原子总数
C、反应前后的总质量 D、元素种类
6、下列氢氧化物碱性最强的是
A、KOH B、LiOH C、NaOH D、CsOH
7.下列有关Na2CO3和NaHCO3性质的比较中,正确的是 ( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3 D.相对分子质量Na2CO3<NaHCO3
8、下列物质热稳定性最强的是 ( )
A、石灰石 B、纯碱(Na2CO3) C、小苏打 D、碳酸氢铵(NH4HCO3)
9.下列变化中,属于物质被氧化的是 ( )
A.CaO→Ca(OH)2 B.Cu2+→Cu C.Fe2+→Fe3+ D.CO2→CO
10.符合H+ +OH-==H2O这一离子方程式的是 ( )
A.氢氧化钡和硫酸 B.氢氧化钡和盐酸 C.氢氧化铜与盐酸 D.烧碱溶液与醋酸
11.下列各组离子在溶液中可大量共存的是 ( )
A.K+,HCO3-,CO32-,Na+ B. H+,Ba2+,NO3-,SO42-
C.S2-,SO42-,K+,H+ D.Ag+,NO3-,Na+,Cl-
12.下列关于过氧化钠的说法中,不正确的是 ( )
A.能与水反应生成碱和氧气 B.是强氧化剂
C.是白色固体 D.能与二氧化碳起反应生成盐和氧气
13.碱金属0.195g与足量的水反应时,生成0.005g氢气,这种金属是 ( )
A.锂 B.钠 C.钾 D.铷
14. 根据以下四个反应:
(1)H2S+I2=2H++2I-+S¯ (2)H2SO3+2H2S=3S¯+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是 ( )
(A)H2S>H2SO3>I->Br- (B)Br->I->H2SO3>H2S
(C)H2SO3>H2S>Br->I- (D)I->Br->H2S>H2SO3
15.对于反应:TiCl4+4Na==4NaCl+Ti,下列说法正确的是 ( )
A.该反应说明钠是强氧化剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化产物 D.NaCl是氧化产物
16.在100℃时,3.6g CO和H2的混合气体与足量的氧气反应后通入装有
足量Na2O2的反应管充分反应,已知CO和H2的质量比为5:1,则反应管增重( ) g
A.5.6 B. 1.6 C.3.2 D.3.6
17.许多城市都禁止燃放烟花爆竹,除噪声污染外,爆竹燃放时会产生一种有刺激性气味的气体,这种气体是 ( )
A.N2 B.Cl2 C.CO D.SO2
18.下列说法正确的是 ( )
① 1965年,我国科学家在世界上第一次用化学方法合成具有生物活性的蛋白质——结晶牛胰岛素。
② 新材料的开发和利用,是社会发展和人类进步的一种标志。
③ 化学反应都有新物质产生,同时伴随着能量变化。
④ 1807年英国化学家汉佛莱·戴维用电解法分离出钠钾。
A. 只有①④ B. 只有②③ C. 只有①②③ D. 以上全部
二、填空题
19.(3分)课本上有这样一个实验:用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。
由实验现象所得出的有关过氧化钠和水反应的结论是:
a.有氧气生成; b. 。
Na2O2与H2O反应的化学方程式是: 。
20. (4分)A.Na2O2 B.Na2CO3 C.NaHCO3 D.K-Na合金 E.Na
(1)广泛用于玻璃、制皂、造纸、纺织工业上的是 ;(填序号,下同)
(2)可用于漂白织物、麦秆、羽毛等的是 ;
(3)可用作原子反应堆的导热剂的是 。(4)食品工业中可用做发酵粉的是 。
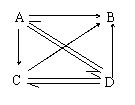 21.(10分)A、B、C、D四种物质含同一种元素,它们之间的相互转化关系如右图。用洁净的铂丝蘸取A的溶液在酒精灯火焰上灼烧,透过蓝色的钴玻璃看
21.(10分)A、B、C、D四种物质含同一种元素,它们之间的相互转化关系如右图。用洁净的铂丝蘸取A的溶液在酒精灯火焰上灼烧,透过蓝色的钴玻璃看
到紫色的火焰,A可由金属与水直接反应制得;B是实验室制O2
时的另一种产物;等质量的C和D分别和过量的盐酸反应时,
产生的CO2,C多于D。试回答:
(1)进行焰色反应时,用_______溶液洗净铂丝;用蓝色的钴玻璃观察焰色的原因________;
(2)写出化学式A B C D
(3)写出有关反应的离子方程式:
①D—→A:_______________________
②A—→C:________________________________
22.(10分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的学化试剂和实验用品。用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
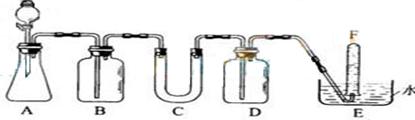
⑴A是制取CO2的装置。写出A中发生反应的化学方程式
⑵B中是饱和NaHCO3溶液,它的作用是 ,反应的离子方程式是 ,
⑶.写出过氧化钠与二氧化碳反应的化学方程式,标出电子转移的方向和数目,指出氧化剂和还原剂.
23.(6分)分析下面氧化还原反应中化合价变化关系,用双线桥标出电子转移方向和数目,并在横线上回答指定问题。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
氧化剂 ,还原剂 ,该反应中盐酸既表现 性,又表现 性。
三、计算题(本题包括2小题,共13分)
24.(4分)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4 g铜被氧化,参加反应的HNO3质量是________,被还原的HNO3质量是________.
25.(9分)现有苏打和小苏打的混合物6.85g,加热至质量不再减少为止,冷却后将所得再跟足量的盐酸反应,放出2.2g二氧化碳。试计算原混合物中苏打和小苏打各占多少?
参考答案:
一、1.D2.B3.D4D5.A6.D.7A8.B9.C10.B11.A12.C13.C14.A15.D16.D17.D18.D
二、19.b.放出热量, 2Na2O2+2H2O=4NaOH+O2↑
20. (1).B(2).A(3).D(4).C
21.(1).盐酸,排除钠离子的干扰(2).KOH; KCl; KHCO3; K2CO3
(3).Ba2++CO2-3 =BaCO3↓ OH-+CO2=HCO - 3
22.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)吸收HCl气体, HCO- 3+H+=H2O+CO2↑
(3) 2Na2O2+2CO2=2Na2CO3+O2 氧化剂和还原剂都是Na2O2
23. KMnO4; HCl; 还原; 酸
24. 16.8g 4.2g
25. NaHCO34.2g Na2CO3 2.65g