
2005-2006学年度下学期
高中学生学科素质训练
高一化学同步测试(8)—硅和二氧化硅、无机非金属材料
说明:本试卷分第一卷和第二卷两部分,第一卷60分,第二卷90分,共100分;答题时间90分钟.
第I卷(共60分)
一、选择题(共6小题,每小题3分,共18分。只有1个正确答案)
1.二氧化硅是酸性氧化物是因为 ( )
A.硅是非金属
B.它是非金属氧化物
C.二氧化硅能跟氢氧化钠反应生成盐和水
D.它的对应水化物是弱酸,能溶于水
2.常温下不能与单质硅反应的试剂是 ( )
A.浓硝酸 B.氢氟酸 C.氢氧化钾溶液 D.氟气
3.宣传科学知识,介绍高新科技,揭露伪科学是科学工作者的义务,下列各项中属于伪科学的是 ( )
A.高温高压下将石墨制成金刚石 B.用催化剂将水变成油
C.将空气中游离态氮转化成化合态 D.用碘化银人工降雨
4.有关材料的用途不正确的是 ( )
A.高温结构陶瓷可以制作耐酸设备 B.氧化铝陶瓷不可以用于制作耐高温设备
C.氮化硅陶瓷可以制造轴承 D.光导纤维可用于传能传像、照明等
5.玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是 ( )
A.烧碱 B.纯碱 C.氢氟酸 D.盐酸
6.硅酸铜钡是当今用最新科学技术才能合成的一种物质。然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的学说错误的是 ( )
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.属于复盐
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)
7.下列变化属于氧化还原反应的是 ( )
A.石灰石煅烧生成CO2和CaO B.纯碱、石灰石、石英共熔制玻璃
C.二氧化硅与氢氧化钠溶液反应 D.过氧化钠吸收CO2放出氧气
8.下列反应不能一步完成的是 ( )
A.SiO2 ® Si B.H2SiO3 ® SiO2
C.SiO2 ® Na2SiO3 D.SiO2 ® H2SiO3
9.关于SiO2和CO2的叙述中,正确的是 ( )
A.两者都是酸性氧化物,故都不跟一切酸反应
B.两者都是具有极性共价键的共价化合物
C.SiO2比CO2的相对分子质量大,故SiO2的熔点、沸点比CO2高
D.两者都能与水反应生成对应的酸
10.在3C+SiO2![]() 2CO↑+SiC的反应中,还原剂与氧化剂的物质的量之比是 ( )
2CO↑+SiC的反应中,还原剂与氧化剂的物质的量之比是 ( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
11.下列有关材料的说法不正确的是 ( )
A.传统的无机非金属材料虽有不少优点,但质脆,经不起热冲击
B.新型无机非金属材料虽然克服了传统无机材料的缺点,但强度比较差
C.高温结构材料具有能受高温、不怕氧化、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.新型无机非金属材料特性之一——具有电学特性
12.下列反应中,为熔炼玻璃的主要反应的是 ( )
A.Na2CO3+CO2+H2O![]() 2NaHCO3
2NaHCO3
B.SiO2+CaO![]() CaSiO3
CaSiO3
C.SiO2+Na2CO3![]() Na2SiO3+CO2
Na2SiO3+CO2
D.Na2CO3+H2SO4![]() Na2SO4+CO2+H2O
Na2SO4+CO2+H2O
13.镁橄榄石Mg2SiO4可以用下列哪一种氧化物形式表示 ( )
A.MgO·SiO2 B.2MgO·SiO2 C.MgO·2SiO2 D.MgO·3SiO2
14.只用一种试剂就能将Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液区别开来,这种试剂是 ( )
A.氢氧化钠溶液 B.澄清石灰水 C.2 mol / L 盐酸 D.2 mol / L 硫酸
15.碳化硼(B4C)陶瓷硬度大,熔点高,具有化学惰性。据此判断,下列不能作为碳化硼陶瓷用途的是 ( )
A.作耐磨材料 B.作润滑材料 C.制切削工具 D.制钢化玻璃
16.下列工业生产中,可以用石灰石作为一种原料的是 ( )
①制石灰 ②制漂白粉 ③制水泥 ④制普通玻璃 ⑤石膏矿制石膏
A.全部 B.除④以外 C.除⑤之外 D.除②以外
第Ⅱ卷(共52分)
三、填空题(共6小题,计43分)
17.(5分)SiO2属_______性氧化物,它__________直接跟水化合成对应的酸,但它是________酸的酸酐。实验室里盛放碱液的玻璃试剂瓶不能用玻璃塞,而常用橡皮塞是因为(用化学方程式表示)_____________________________________________; 玻璃瓶也不能盛装氢氟酸,是因为(用化学方程式表示)_____________________________________。
18.(6分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸部,商人
们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商
人们惊奇地发现“灶”变成了晶莹透明的固体。这种固体可能是 ,其主要
成分是 。
19.(4分)如何用最简捷的方法检验硅酸盐和碳酸盐 ,观察到的现象分别为 。
20.(10分)化合物A、D、F是中学化学中常见的物质,化合物B、C、E中含有两种相同的元素。这些化合物之间存在下图4的关系。其中A和B的反应是一种重要化工生产中的主要反应之一。
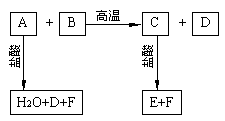
(1)在A、C、F中含有相同元素是 ;
(2)化合物C的化学式是 ,化合物A的水溶液显 性(填“酸”、“碱”或“中”)。
(3)C的水溶液和D能否发生反应? ,其理由是 。
21.(8分)我国古代炼丹中经常使用到红丹,俗称铅丹。在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3![]() PbO2+2Pb(NO3)2+2H2O。
PbO2+2Pb(NO3)2+2H2O。
(1)铅丹的化学式是_________,此铅丹中铅的化合价是_______。
(2)由此反应可推测PbO是_______性氧化物,PbO2是_______性氧化物。
22.(10分)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________(填序号)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)写出N的原子结构示意图:________,根据元素周期律知识,请写出氮化硅的化学式:________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为________。
四、计算题(9分)
23.将6.9 g钠和4.2 g硅同时投入盛足量蒸馏水的大烧杯中,在标准状况下能收集到多少升氢气?气体放完后得溶液体积恰好为500 mL,求溶液中溶质的物质的量浓度。(提示:Si+2NaOH+H2O ![]() Na2SiO3+2H2↑)
Na2SiO3+2H2↑)
参考答案
一、选择题
1.C 2.A 3.B 4.B 5.C 6.A
二、选择题
7.D 8.D 9.B 10.D 11.B 12.C13.B 14.D 15.BD 16.C
三、填空题
17.酸性;不能;硅;原硅;;木塞或胶;2NaOH+SiO2![]() Na2SiO3+H2O;
Na2SiO3+H2O;
SiO2+4HF![]() SiF4+2H2O
SiF4+2H2O
18.玻璃;Na2SiO3 和SiO2
19.分别加HNO3;前者难溶或有难溶性物质生成,后者溶解且有气体生成。
20.(1)![]() 或K (2)
或K (2)![]() 或
或![]() ;碱
;碱
(3)能;硅酸盐能在水溶液中与D(![]() )反应生成酸性更弱的硅酸
)反应生成酸性更弱的硅酸
21.(1)Pb3O4;+2和+4。(2)碱;酸。
(1)根据质量守恒定律,可确定铅丹的化学式为Pb3O4,根据铅在元素周期表中的位置(或原子结构),可确定铅可呈+2、+4价,继而改写化学式为2PbO•PbO2。
(2)根据氧化物能否与酸反应判断其氧化物的属性。
22.(1)A、C、D(2)![]() ; Si3N4
; Si3N4
(3)Si3N4+12HF![]() 3SiF4+4NH3 (4)3SiCl4+2N2+6H2
3SiF4+4NH3 (4)3SiCl4+2N2+6H2![]() Si2N4+12HCl
Si2N4+12HCl
根据N和Si的原子结构及其元素周期律的知识,可判断氮元素非金属性比硅强,故N显负价(-3),Si显正价(+4),由此可写出氮化硅的化学式Si3N4。
四、计算题
23.(1)n (Na) =![]() = 0.3 mol
= 0.3 mol
n (Si) =![]() = 0.15 mol
= 0.15 mol
两者恰好完全反应生成Na2SiO3,
n (H2)= n (Na) = 0.3 mol V (H2)=0.3 mol×22.4 L·mol-1 =6.72 L
(2)n (Na2SiO3)=n(Si)=0.15 mol
c(Na2SiO3)=![]() =0.3 mol·L-1
=0.3 mol·L-1