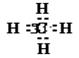安徽省潜山中学2005—2006学年度第二学期期中考试
高 一 化 学 试 题
本卷分为第Ⅰ卷和第Ⅱ卷两部分,请将第Ⅰ卷的答案填入第Ⅱ卷中的答题表中。
第Ⅰ卷(共44分)
一. 选择题(每题只有一个答案正确,每小题2分,共20分)
1. 1998年5月20日,中央电视台第一套节目《新闻联播》播放了一则新闻:近年来我国重点保护文物“云岗石窟”严重腐蚀风化,急剧损坏。其主要原因是在它的旁边新修了一条高速公路。我国不惜花费二亿元资金另修一条路,让公路绕道而行来保护这一珍贵的文物。通过这则新闻你认为造成腐蚀损坏的主要原因是 ( )
A.车辆排放大量尾气 B.居民燃 C.车辆尘埃 D.风吹日晒
2.由下列实验事实得出结论正确的是 ( )
A.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
B.室温下,浓硫酸可以用铝槽车装运,说明室温下浓硫酸与铝不反应
C.SO2既可以与NaOH反应又可以与HNO3反应,说明SO2是两性氧化物
D.Na2SO4中硫元素处于最高价,说明Na2SO4溶液具有强氧化性
3.将SO2通入BaCl2溶液中至饱和,未见沉淀,继续通入另一种气体至过量仍无沉淀,则通入的气体可能是 ( )
A.CO2 B.NH3 C.H2S D.SO3
4.已知A元素的原子序数为W,B元素的阳离子![]() 和A元素的阴离子
和A元素的阴离子![]() 具有相同的电子层结构,则B原子的核外电子数为
( )
具有相同的电子层结构,则B原子的核外电子数为
( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物的化学式为![]()
D.R的气态氢化物比同周期其它元素气态氢化物均稳定
6.某三价金属阳离子具有28个电子,其质量数为70,那么它核内的中子数为 ( )
A.28 B.31 C.39 D.42
7.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从![]() 的溶液中置换出来
的溶液中置换出来
8.下列说法正确的是 ( )
A.离子化合物中可能含有共价键 B.离子化合物中不可能含有共价键
C.共价化合物中可能含有离子键 D.H2O2中不含非极性键
9.元素性质呈现周期性变化的根本原因是: ( )
A.元素的原子量逐渐增大 B.核外电子排布呈周期性变化
C.核电荷数逐渐增大 D.元素化合价呈周期性变化
10.下列关于臭氧性质的叙述中不正确的是 ( )
A.臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂
D.臭氧和氧气一定条件下可以相互转化
二、选择题(每题只有一个答案正确,每小题3分,共24分)
11.下列反应中,调节反应物的用量或浓度不会改变反应产物的是 ( )
A.H2S在氧气中燃烧 B.铁在硫蒸气中燃烧
C.二氧化硫通入石灰水中 D. 硫酸中加入锌粉
12.A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8 B.n+18 C.n+32 D.n+20
13.以下说法错误的是 ( )
A.O3和O2是氧元素的同素异形体
B.![]() 可加快
可加快![]() 的分解速率
的分解速率
C.标准状况下,22.4L ![]() 的物质的量是1 mol
的物质的量是1 mol
D.![]() 与
与![]() 在加热条件下发生反应的产物为
在加热条件下发生反应的产物为![]()
14.质量分数为4a的硫酸和质量分数为2a的硫酸等体积混合后,所得溶液的质量分数为( )
A.大于3a B.小于3a C.等于3a D.无法确定
15.下列化合物不能由相应的元素的单质直接化合得来的是 ( )
① CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2Te ⑧H2S
A.②⑤⑧ B.①④⑥ C.③④⑦ D.①④⑥⑦
16.在短周期元素中,两种元素X、Y可形成多种XY3型化合物。下列说法错误的是( )
A.化合物XY3溶于水形成的溶液可能显酸性也可能显碱性
B.X和Y可能属于同一周期,也可能属于不同周期
C.X的化合价可能显正价也可能显负价
D.X和Y一定属于同一主族
17.下列说法正确的是:(NA表示阿伏加德罗常数的数值) ( )
A.20gH218O和34g H2O2中均含有2NA对共用电子对
B.1molNa2O2与1molNa2O所含阴离子数分别是:2NA个和NA个
C.常温常压下,3.5g35Cl2所含原子数为0.1NA
D.常温常压下,22.4LO3气体含有3NA个原子
18.几种短周期元素的原子半径及主要化合价见下表: ( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
下列叙述不正确的是 ( )
A.L,R的单质与盐酸反应的剧烈程度:前者强于后者
B.Q,T两元素形成的化合物有两种
C.L,Q形成的简单离子核外电子数相等
D.M,T形成的化合物既可以与酸反应又可以与碱反应
 安徽省潜山中学2005—2006学年度第二学期期中考试
安徽省潜山中学2005—2006学年度第二学期期中考试
高 一 化 学 试 题
请将选择题答案填入下表:
一. 选择题(每题只有一个答案正确,每小题2分,共20分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、选择题(每题只有一个答案正确,每小题3分,共24分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
三、填空题(24分)
19(8分)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
(1)原子半径最大的是 _______ , 简单离子中, 离子半径最大的是 _____ 。
(2)气态氢化物最稳定的是 ___ , 气态氢化物中含有H 元素质量分数最大的氢化物是___。
(3)酸性最强的无氧酸是______,酸性最强的含氧酸是 _________,碱性最强的是_______,属于两性氢氧化物的物质是___________.
20.(8分)短周期四种元素A、B、C、D原子序数依次增大,A元素原子最外层电子数为次外层电子数的2倍,C元素原子的次外层电子数为最外层电子数的2倍,C与D可形成共价化合物CD4,B与D可形成离子化合物BD2。
(1)用电子式表示BD2的形成过程: .其中离子半径的大小关系:B D(填“>”或“<”=
(2)A、C、D三种元素所对应的气态氢化物中,最不稳定的是 (填电子式),最高价氧化物的水化物酸性最强的是 (填分子式)。
21.(8分)A、B是两种有刺激性气味的气体,试根据以下物质之间的反应关系推断:
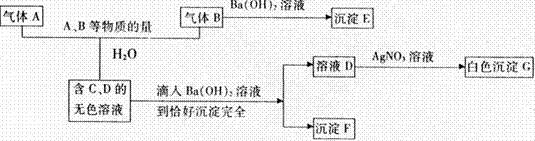
(1)A→G各是什么物质,其化学式分别是:A________,B________,C____,D________,E_________F______.G________。
(2)写出A、B与水三者反应的离子方程式:______________________________________。
四.实验题
22.(12分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①请写出铜跟浓硫酸反应的化学方程式:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①请写出铜跟浓硫酸反应的化学方程式:
___________________ __ 。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
__________________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_____(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_______(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量酸性KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙学生设计的方案操作更简单,但能同样达到目的。请你帮助乙同学设计一个实验方案。
____________________________________________________________
23.(4分)选用合适的试剂除杂括号内的为杂质
CO2( (SO2) __________________ SO2(HCl )___________________
H2S(HCl)___________________ Cl2(HCl)___________________
五.计算题(16分)
24(8分) 0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素中子比质子多一个。求R的相对原子质量及在元素周期表中的位置。
25(8分)在铜片中加入某浓度的硫酸35.3mL,在加热条件下反应,待铜片全部溶解后,测得所生成的SO2在标况下的体积为5.6L。将所得的溶液稀释到150mL,再加入足量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后质量为93.2g。求原硫酸的物质的量浓度?
安徽省潜山中学高一化学期中考试答案
一、选择题(每题2分, 共计20分)
1.A 2.A 3A 4.B 5C. 6.C 7.C 8. A 9.B 10.C
二.选择题(每题3分, 共计24分)
11.B 12.D 13.C 14.A 15.D 16.D 17.C 18.C
三填空题(24分)
19(8分) ( 1) Na , P 3-( S2-) (2) HF, CH4
(3) HCl , HClO4 , NaOH , Al(OH)3
20(8分)
|
|
|
(2) ; HClO4
l 21(8分每空1分)(1)A_ Cl2_,B__SO2_ C H2SO4,D. HCl E. _BaSO3_,F _BaSO4
(2)_SO2+Cl2+2H2O=4H++SO42-+2Cl-
四. 实验题
22(12分)( 每空2分)
(1)B装置中导气管长进短出;
(2)①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O;②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应; ③A、D;
CuSO4 + SO2↑+ 2H2O;②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应; ③A、D;
(3)①A、B、C; ②取出剩余的铜片,洗涤干燥后称量,根据消耗铜片的质量,再计算余酸的浓度。(各2分)
23(4分) .NaHCO3溶液 NaHSO3溶液 NaHS 饱和NaCl溶液(各1分)
. 五计算题(16分)
24(8分). 27, 第三周期第ⅢA族
25(8分) 18.4mol/L